-
下列说法正确的是( )
A.在化学反应中,发生物质变化的同时不一定发生能量变化
B.反应:MgCO3(s)===MgO(s)+CO2(g) ,在高温下不能自发进行
C.HR溶液导电性较弱,则HR属于弱电解质
D.反应产物的总焓大于反应物的总焓时,ΔH>0
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=1的溶液中:Fe2+、NO
、SO
、Na+
B.由水电离的c(H+)=1×10-14mol·L-1的溶液中:Ca2+、K+、Cl-、HCO
C.c(H+)/c(OH-)=1012的溶液中:NH
、Al3+、NO
、Cl-
D.c(Fe3+)=0.1 mol·L-1的溶液中:K+、ClO-、SO
、SCN-
难度: 中等查看答案及解析
-
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是 ( )
A.
B.
C.c(H+)和c(OH-)的乘积 D.OH-的物质的量
难度: 中等查看答案及解析
-
在2A+B⇌3C+4D反应中,表示该反应速率最快的是( )
①单位时间内生成a mo1 O2的同时生成2a mol NO2
②单位时间内生成a mol O2的同时生成2a molNO
③混合气体的颜色不再改变
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③④ B.②④⑤ C.①③⑤ D.①②③④⑤
难度: 中等查看答案及解析
-
在密闭容器中反应:aX(g)+bY(g)⇌cZ(g)+dW(g),反应达到平衡后,保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍.下列叙述不正确的是 ( )
A.平衡向逆反应方向移动 B. a+b>c+d
C.Z的体积分数减小 D. X的转化率下降
难度: 困难查看答案及解析
-
反应aA(g)+bB(g)⇌cC(g)△H,生成物C的质量分数与压强P和温度T的关系如图, 方式中的系数和△H的大小符合图象的是( )
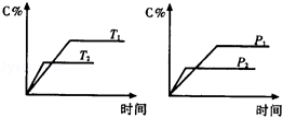
A.a+b=c △H>0 B.a+b>c △H<0
C.a+b<c △H>0 D.a+b<c △H<0
难度: 中等查看答案及解析