-
下列过程一定涉及氧化还原反应的是( )
A.萃取 B.电解 C.净水 D.分馏
难度: 中等查看答案及解析
-
在25℃、1×105Pa时,等质量的H2、Cl2、CO2、C2H2四种气体中( )
A. H2分子数最大 B. C2H2原子数最大
C. CO2密度最大 D. Cl2分子间平均距离最大
难度: 中等查看答案及解析
-
基于实验现象的推论,你认为合理的是( )
选项
实验现象
推论
A
乙烯气体可以使溴水褪色
乙烯发生取代反应
B
浓硫酸电导率比较低
硫酸浓度大时是弱电解质
C
氨气用于喷泉实验
氨气极易溶于水
D
硝酸溶液使pH试纸先变红后变白
硝酸酸性太强不能用pH试纸检测
难度: 中等查看答案及解析
-
对于相应化学用语的推论合理的是( )
选项
化学用语
推论
A
U3+
该铀离子核外有89个电子
B
2H2(g)+O2(g)= 2H2O(g);△H=-483.6kJ•mol
1mol氢气完全燃烧放出热量483.6kJ.
C
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
NaCl氧化性比Cl2强
D
FeO+4H++NO3―= Fe3++NO2↑+2H2O
氧化亚铁溶于稀硝酸的离子方程式
难度: 中等查看答案及解析
-
在密闭容器中进行反应:X(g)+3Y(g)
2Z(g),下列说法正确的是 ( )
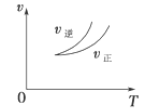
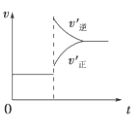
A.左上图说明正反应为吸热反应
B.反应达平衡后,增大压强气体密度将减小
C.右上图可表示升高温度使平衡向逆反应方向移动
D.右上图虚线可表示使用催化剂后引发的反应速率变化
难度: 中等查看答案及解析
-
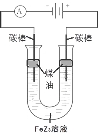
甲醇燃料电池体积小巧、洁净环保、理论能量比高,已在便携式通讯设备、汽车等领域应用。某型甲醇燃料电池的总反应式2CH4O + 3O2 = 2CO2↑+ 4H2O,下图是该燃料电池的示意图。下列说法错误的是( )
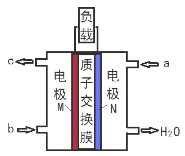
A.燃料电池将化学能转化为电能
B. a是甲醇、b是氧气
C.质子从M电极区穿过交换膜移向N电极区
D.负极反应:CH4O - 6e- + H2O = CO2↑+ 6H+
难度: 中等查看答案及解析
-
常温下,向l00mL 0.01 mol•L-1 盐酸中逐滴加入0.02 mol•L-1 MOH溶液,如下图所示,曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是( )
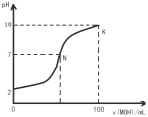
A.MOH是弱碱
B.N点c(Cl-) = c(M+)
C.随着MOH溶液的滴加,比值
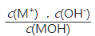 不变
不变D.K点对应的溶液c(MOH)+c(OH-)-c(H+) = 0.005 mol•L-1
难度: 中等查看答案及解析

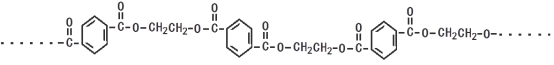
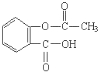 )的原料。
)的原料。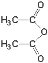 )反应生成阿司匹林的化学方程式:
)反应生成阿司匹林的化学方程式: