-
在0.1mol•L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH⇌CH3COO-+H+对于该平衡,下列叙述正确的是( )
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向正反应方向移动
C.加入少量0.1mol•L-1 HCl溶液,平衡向正反应方向移动
D.加入少量CH3COONa固体,平衡向正反应方向移动难度: 中等查看答案及解析
-
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A.Na2SO4
B.H2SO4
C.AgNO3
D.NaOH难度: 中等查看答案及解析
-
一定条件下反应2AB(g)⇌A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成n mol A2,同时消耗2n mol AB
B.容器内,3种气体AB、A2、B2物资的量相等
C.在恒容容器中,容器内压强不再变化
D.容器中各组分的体积分数不随时间变化难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.pH=6的溶液一定呈酸性
B.不溶于水的物质的溶解度为0
C.绝对不溶解的物质是不存在的
D.某离子被沉淀完全是指该离子在溶液中的浓度为0难度: 中等查看答案及解析
-
在5.0mlNaCl溶液中加入3滴AgNO3溶液,有白色沉淀生成;再加入3滴KI溶液沉淀转化为黄色,然后再加入3滴Na2S溶液,沉淀又转化为黑色(以上所用的溶液物质的量浓度均相同),下列表示各沉淀物溶度积由大到小的顺序正确的是( )
A.Ag2S AgI AgCl
B.AgCl AgI Ag2S
C.AgI AgCl Ag2S
D.AgCl Ag2S AgI难度: 中等查看答案及解析
-
能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是( )
A.向水中投入一小块金属钠
B.将水加热煮沸
C.向水中通入二氧化碳气体
D.向水中加食盐晶体难度: 中等查看答案及解析
-
压强变化不会使下列化学反应的平衡发生移动的是( )
A.C(s)+CO2(g)⇌2CO(g)
B.3H2(g)+N2(g)⇌2NH3(g)
C.2SO2(g)+O2(g)⇌2SO3(g)
D.H2(g)+I2(g)⇌2HI(g)难度: 中等查看答案及解析
-
只用一种试剂,能将NH4Cl、(NH4)2SO4、NaCl、NaSO4四种溶液区分开,这种试剂是( )
A.NaOH溶液
B.AgNO3溶液
C.BaCl2溶液
D.Ba(OH)2溶液难度: 中等查看答案及解析
-
体积相同,pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时两者消耗NaOH溶液的物质的量( )
A.相同
B.中和HCl的多
C.无法比较
D.中和CH3COOH的多难度: 中等查看答案及解析
-
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程上来,其主要的原因是( )
A.利用电池外壳的金属材料
B.不使电池中渗泄的电解质溶液腐蚀其他物品
C.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
D.回收其中石墨电极难度: 中等查看答案及解析
-
A、B、C都是金属,A中混有C时,A先腐蚀;A与B组成原电池时,A为电池的正极.A、B、C三种金属的活动顺序为( )
A.A>B>C
B.A>C>B
C.B>C>A
D.B>A>C难度: 中等查看答案及解析
-
曾对化学平衡进行研究并提出平衡移动原理的化学家是( )
A.勒夏特列
B.门捷列夫
C.道尔顿
D.拉瓦锡难度: 中等查看答案及解析
-
中小学生经常使用的涂改液中含有挥发性的有毒溶剂,应尽量不使用,以减少对身体的毒害及对环境的污染.该溶剂是( )
A.乙醇
B.乙酸
C.三氯乙烯
D.甘油难度: 中等查看答案及解析
-
下列装置能构成原电池的是( )
A.
稀硫酸
B.
稀硫酸
C.
稀硫酸
D.
无水乙醇难度: 中等查看答案及解析
-
一密闭烧瓶中装有NO2气体,在一定条件下达到化学平衡,现将该烧瓶放在热水中,则( )
A.颜色不变
B.颜色变浅
C.颜色变深
D.无法判断难度: 中等查看答案及解析
-
如图所示,烧杯内盛水,铁圈和银圈直接相连接,在接头处用一根绝缘细线吊住使之平衡,小心地向烧杯中央滴入CuSO4溶液,一段时间后可观察到的现象是( )

A.两圈仍保持平衡
B.铁圈向下倾斜
C.银圈向下倾斜
D.有气泡产生,两圈摇摆不定难度: 中等查看答案及解析
-
下列说法正确的是( )
A.分子的每一次碰撞都能够发生化学反应
B.反应物用量增加后,有效碰撞次数增多,反应速率增大
C.能够发生有效碰撞的分子叫做活化分子
D.加入催化剂对化学反应速率无影响难度: 中等查看答案及解析
-
下列方程式中是某种盐的水解方程式的是( )
A.HCO3-+H2O⇌CO32-+H3O+
B.Zn-2e-=Zn2+
C.NaHSO4=Na++H++SO42-
D.AlO2-+2H2O⇌Al(OH)3+OH-难度: 中等查看答案及解析
-
下列热化学方程式中△H代表燃烧热的是( )
A.CH4(g)+O2(g)=2H2O(l)+CO(g)△H1
B.S(s)+O2(g)=SO3(s)△H2
C.C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H3
D.2CO(g)+O2(g)=2CO2(g)△H4难度: 中等查看答案及解析
-
在2A+B═3C+4D反应中,表示该反应速率最快的是( )
A.υ(B)=0.3 mol•-1
B.υ(A)=0.5 mol•-1
C.υ(C)=0.8 mol•-1
D.υ(D)=1 mol•-1难度: 中等查看答案及解析
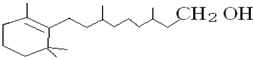 式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C.H原子未标记出来,维生素A中碳原子个数为________个,氧原子个数为________个.
式中以线示键,线的交点与端点处代表碳原子,并用氢原子数补足四价,但C.H原子未标记出来,维生素A中碳原子个数为________个,氧原子个数为________个.  ________
________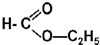 ________.
________.