-
化学与STSE(社会、科学、技术和环境)密切相关,下列说法正确的是
①寻找合适催化剂提高合成氨工业中原料的转化率
②氟氯烃分解产生的氯原子因能降低臭氧分解的活化能而加速臭氧的分解反应
③氟化物防止龋齿所涉及到的化学原理其实就是沉淀的转化
④煤气中毒或救治与氧气、一氧化碳和血红蛋白结合过程中的化学平衡移动有关
A.①②③ B.②③④ C.①④ D.③④
难度: 简单查看答案及解析
-
下图实验装置一般不用于分离物质的是

难度: 中等查看答案及解析
-
最新报道:科
学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:

下列说法中正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO
断键形成C和O
C.CO和O生成了具有极性共价键
的
CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
难度: 中等查看答案及解析
-
己烯雌酚是一种激素类药物,结构如图所示,下列有关叙述中正确的是

A.该有机物属于芳香烃
B.该物质不能使酸性高锰酸钾溶液褪色
C.该分子对称性好,所以没有顺反异构
D.该有机物分子中,最多可能有18个碳原子共平面
难度: 中等查看答案及解析
-
请根据下列反应:
C(s)+O2(g) = CO2(g) ΔH1
CO2(g)+C(s) = 2CO(g) ΔH2
2CO(g)+O2(g) = 2CO2(g) ΔH3
4Fe(s)+3O2(g) = 2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s) = 3CO2(g)+2Fe(s) ΔH5
关于上述反应焓变的判断正确的是
A.ΔH1>0,ΔH3<0 B.ΔH2>0,ΔH4>0
C.ΔH1=ΔH2+ΔH
3 D.ΔH3=ΔH4+ΔH5
难度: 困难查看答案及解析
-
有机物
 的名称为
的名称为A.2,2,3-三甲基-1-戊炔 B.3,4,4-三甲基-l-戊炔
C.3,4,4-三甲基辛炔 D.2,2,3-三甲基-4-戊炔
难度: 中等查看答案及解析
-
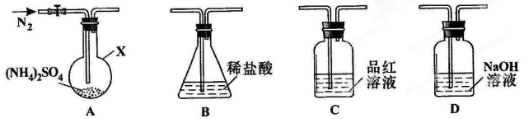
某学生欲完成反应2Ag+2HCl = 2AgCl↓+H2↑,设计了四个实验,你认为可行的是

难度: 中等查看答案及解析
-
高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析,以下观点中不正确的是
①放热反应在常温下均能自发进行;
②电解过程中,化学能转化为电能而“储存”起来
;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,化学反应只向吸热反应方向进行;
⑤盐类均能发生水解反应;
⑥化学平衡常数的表达式与化学反应方程式的书写无关。
A.①②④⑤ B.①④⑤⑥
C.②③⑤⑥ D.①②④⑤⑥
难度: 中等查看答案及解析
-
下列物质属于苯的同系物的是
A B C D
难度: 中等查看答案及解析
-
下列式子属于水解反应,且溶液呈酸性是
A.碳酸氢钠溶于水:HCO3﹣+H2O
H3O++CO32﹣
B.氯化铁溶于水Fe3++3H2O
Fe(OH)3+3H+
C.硫氢化钠溶于水: HS﹣+H2O
H2S+OH﹣
D.甲酸溶于水:HCOOH+H2O
HCOO﹣+H3O+
难度: 中等查看答案及解析
-
由乙炔为原料制取CHClBr-CH2Br,下列方法中,最可行的是
A.先与HBr加成后,再与HCl加成
B.先与H2完
全加成后,再与Cl2、Br2取代
C.先与HCl加成后,再与Br2加成
D.先与Cl2加成后,再与
HBr加成
难度: 中等查看答案及解析
-
用一种试剂鉴别1-己烯、碘化钾溶液、苯、四氯化碳四种液体,应选用
A. 盐酸 B. FeCl3溶液 C. 水 D. 溴水
难度: 中等查看答案及解析
-
25℃时,在10 mL浓度均为0.1mol/L NaOH和NH3·H2O混合溶液中,滴加0.1mol/L的盐
酸,下列有关溶液中粒子浓度关系正确的是
A.未加盐酸时:c(OH-)>c(Na+)= c(NH3·H2O)
B.加入10 mL盐酸时:c(NH4+) +c(H+) =c(OH-)
C.加入盐酸至溶液pH=7时:c(Cl-) = c(Na+)
D.加入20 mL盐酸时:c(Cl-) =c(NH4+) +c(Na+)
难度: 困难查看答案及解析
-
实验室用溴和苯在FeBr3催化下制取溴苯,得到粗溴苯后,要用如下操作提纯:
①蒸馏;②水洗;③用干燥剂干燥;④用10%的NaOH溶液洗涤。正确的操作顺序是
A. ②④②③① B. ④②③① C. ④①②③ D. ①②③④
难度: 中等查看答案及解析
-
如下8种物质中:①甲烷 ②聚乙烯 ③苯 ④氯乙烯 ⑤2-丁炔 ⑥环己烷 ⑦邻二甲苯 ⑧2-甲基-1,3-丁二烯,既能使酸性高锰酸钾溶液褪色,又能与溴水起加成
反应使之褪色的是
A.③④⑤⑧ B.④⑤⑦⑧ C.④⑤⑧ D.③④⑤⑦⑧
难度: 中等查看答案及解析
-
对于0.1mol·L-1的Na2S溶液,下列判断正确的是
A.向溶液中加入少量NaOH固体,能促进水的电离
B.c(Na+)=2c(S2-)+c(OH-)+c(HS-)
C.向Na2S溶液中加水稀释,其所有离子的浓度都减小
D.溶液中阴离子浓度的大小顺序:c(S2-)>c(OH-)>c(HS-)
难度: 中等查看答案及解析
-
下列叙述正确的是
A.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度
B.25℃时,等体积等浓度的硝酸
与氨水混合后,溶液pH=7
C.25℃时,0.1mol·L1的硫化氢溶液比等浓度的硫化钠溶液的导电能力弱
D.0.1 m
ol AgCl和0.1mol AgI混合后加入1L水中,所得溶液中c(Cl-)=c(I-)
难度: 中等查看答案及解析
-
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
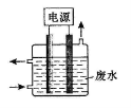
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl-+2OH--2e=ClO-+H2O
C.阴极的电极反应式为:2H2O+2e=H2↑+2OH-
D.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
难度: 困难查看答案及解析