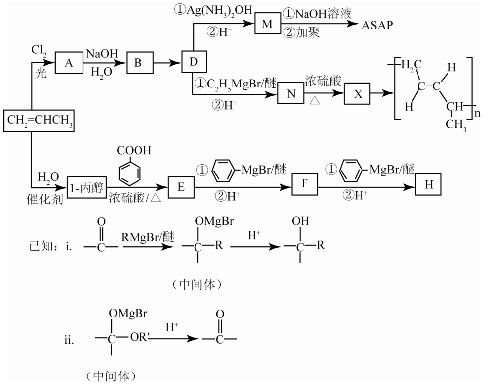
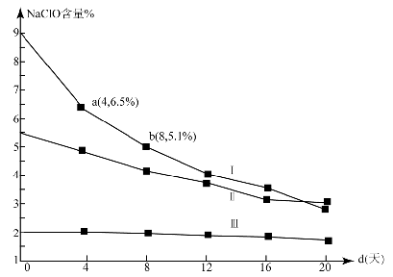
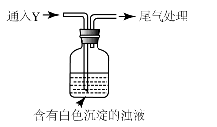
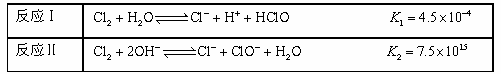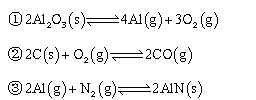-
塑料的合理回收是再利用的关键,焚烧会产生大量HCl气体的是

难度: 简单查看答案及解析
-
下列物质的用途利用了其还原性的是
A.用葡萄糖制镜或保温瓶胆 B.用Na2S除去废水中的Hg2+
C.用NaHCO3治疗胃酸过多 D.用Na2SiO3溶液制备木材防火剂
难度: 中等查看答案及解析
-
下列解释事实的方程式不正确的是
A.铝热法炼铁:
B.工业进行“氮的固定”:
C.铅蓄电池充电时阴极反应:
D.用铜和稀硝酸制备硝酸铜:
难度: 中等查看答案及解析
-
用灼烧法证明海带中含有碘元素,各步骤选用的实验用品不必都用到

难度: 困难查看答案及解析
-
如图为锌铜显示原电池装置图,下列说法不正确

A.电子由Zn极流向Cu极
B.该装置的总反应
C.一段时间后,A池带正电荷,B池带负电荷
D.取出盐桥,电流计指针不再偏转
难度: 困难查看答案及解析
-
根据元素周期律,由列事实进行归纳推测,推测不合理的是事实
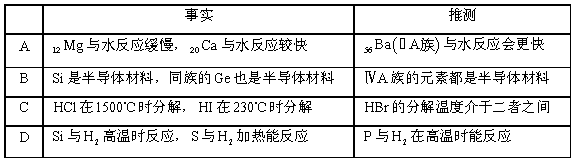
难度: 困难查看答案及解析
-
下列①②对应的试剂(或条件)不能完成实验目的的是

难度: 困难查看答案及解析