-
化学与生产、生活、环境密切相关,下列说法不正确的是( )
A. 涤纶是一种合成纤维,合成它的单体是对苯二甲酸与乙二醇
B. Fe2O3俗称铁红,常用作红色油漆及涂料
C. “神舟十号”太阳能电池板的主要成分是二氧化硅
D. “光化学烟雾”的形成与氮氧化合物有关
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是
①lmolCH3CH2C(CH3)3所含甲基个数为4NA
②2.8g乙烯和2.8g聚乙烯中含碳原子数均为0.2NA
③1.0L1.0mol/LCH3COOH溶液中,CH3COOH分子数为NA
④8.8g乙酸乙酯中含共用电子对数为1.4NA
⑤标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA
⑥常温常压下,17g甲基(一14CH3)所含的中子数为9NA
⑦标准状况下,11.2L氯仿中含有C—Cl键的数目为1.5NA
⑧lmolC15H32分子中含碳碳键数目为14NA
A.①③⑤⑦ B.①②④⑧ C.②③⑥⑧ D.①②⑥⑧
难度: 困难查看答案及解析
-
能正确表示下列反应的离子方程式是( )
A. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O==HClO+HSO3-
B. 0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合: Al3++2SO42-+2Ba2++4OH- =2BaSO4+AlO2-+ 2H2O
C. 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO
+ 6H+ + 5H2O2 = 2Mn2+ + 5O2↑ + 8H2O
D. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H+ +2I-=2Fe2+ +I2 +3H2O
难度: 中等查看答案及解析
-
下列对实验操作及结论的描述不正确的是( )
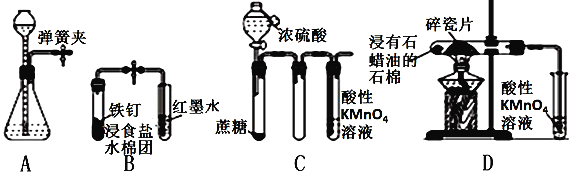
A. 夹紧弹簧夹,由长颈漏斗加水至产生液面差,一段时间后液面差不变,说明气密性良好
B. 打开弹簧夹,红墨水倒吸入导气管中,说明铁钉发生了吸氧腐蚀
C. 滴加浓硫酸后,高锰酸钾溶液褪色,说明浓硫酸使蔗糖脱水的同时还产生了二氧化硫
D. 加热片刻后高锰酸钾溶液褪色,说明石蜡油分解产生了乙烯
难度: 简单查看答案及解析
-
25℃时,用Na2S沉淀Cu2+、Zn2+两种金属离子(M2+),所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示,下列说法不正确的是( )
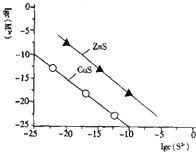
A. 向Cu2+浓度为10-5mol•L-1的工业废水中加入ZnS粉末,会有CuS沉淀析出
B. 25℃时K甲(CuS)约为1×10-35
C. 向100mLZn2+、Cu2+浓度均为10-5mol•L-1的混合溶液中逐滴加入10-4 mol•L-1的Na2S溶液,Cu2+先沉淀
D. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)═2c(Na+)
难度: 中等查看答案及解析
-
某实验小组依据反应:AsO43- + 2H+ + 2I- ⇌ AsO33- + I2 + H2O 设计如图原电池,探究pH对AsO43-氧化性的影响.测得电压与pH的关系如图.下列有关叙述错误的是( )
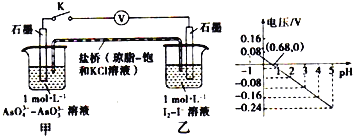
A. pH = 0.68时,反应处于平衡状态 B. 调节pH可以改变反应的方向
C. pH > 0.68时,负极电极反应式为2I——2e— ═I2 D. pH = 5时,氧化性I2 > AsO43-
难度: 中等查看答案及解析
-
下列浓度关系正确的是( )
A. 0.1 mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H +)
B. 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液: c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
难度: 困难查看答案及解析
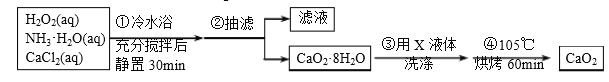



 }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下:
 。
。
 ,写出合成该涂料的反应流程图:________________________________。
,写出合成该涂料的反应流程图:________________________________。