-
欲迅速除去铁壶底的水垢,最好的办法是用( )
A.浓盐酸 B. 稀硝酸 C. 浓硫酸 D. 浓硝酸
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法不正确的是( )
A.乙烯可作水果的催熟剂
B. 硅胶可作袋装食品的干燥剂
C.福尔马林可作食品的保鲜剂
D. 氢氧化铝可作胃酸的中和剂
难度: 简单查看答案及解析
-
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.1mol FeI2与足量氯气反应时转移的电子数为2NA
B.2L 0.5mol•L﹣1硫酸钾溶液中阴离子所带电荷数为NA
C.1mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42g混合气体中氢原子的个数为6NA
难度: 困难查看答案及解析
-
下列实验中,所采取的分离方法与对应原理都正确的是( )
选项
目的
分离方法
原理
A
分离溶于水中的碘
乙醇萃取
碘在乙醇中的溶解度较大
B
分离乙酸乙酯和乙醇
分液
乙酸乙酯和乙醇的密度不同
C
除去KNO3固体中混杂的NaCl
重结晶
NaCl在水中的溶解度很大
D
除去丁醇中的乙醚
蒸馏
丁醇与乙醚的沸点相差较大
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是( )
A. Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH﹣+O2↑
B. 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3﹣=3Fe2++2NO↑+4H2O
C. 氯化镁溶液与氨水反应:Mg2++2OH﹣=Mg(OH)2↓
D. 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+AlO2﹣+2H2O
难度: 中等查看答案及解析
-
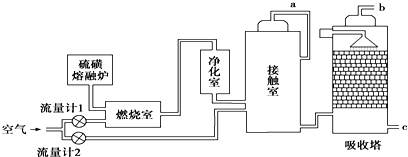
在1200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+
O2(g)═SO2(g)+H2O(g)△H1
2H2S(g)+SO2(g)═
S2(g)+2H2O(g)△H2
H2S(g)+
O2(g)═S(g)+H2O(g)△H3
2S(g)═S2(g)△H4
则△H4的正确表达式为( )
A.△H4=
(△H1+△H2﹣3△H3)
B. △H4=
(3△H3﹣△H1﹣△H2)
C.△H4=
(△H1+△H2﹣3△H3)
D. △H4=
(△H1﹣△H2﹣3△H3)
难度: 中等查看答案及解析
-
已知温度T时水的离子积常数为KW,该温度下,将浓度为a mol•L﹣1的一元酸HA与b mol•L﹣1一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )
A. a=b
B. 混合溶液的pH=7
C. 混合溶液中,c(H+)=
mol•L﹣1
D. 混合溶液中,c(H+)+c(B﹣)=c(OH﹣)+c(A﹣)
难度: 中等查看答案及解析
-
己知N2(g)+3H2(g)
2NH3(g)△H=﹣92.4kJ•mo1﹣1,下列结论正确的是( )
A. 在密闭容器中加入1mol N2和3mol H2充分反应放热92.4kJ
B. N2(g)+3H2(g)
2NH3(l)△H=﹣QkJ•mo1﹣1,则Q>92.4
C. 增大压强,平衡向右移动,平衡常数增大
D. 若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率为60%
难度: 中等查看答案及解析
-
X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子.则这四种金属的活动性由强到弱的顺序为( )
A.X>Y>Z>M B. X>Z>Y>M C. M>Z>X>Y D. X>Z>M>Y
难度: 中等查看答案及解析
-
四联苯
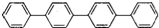 的一氯代物有( )
的一氯代物有( )A. 3种 B. 4种 C. 5种 D. 6种
难度: 中等查看答案及解析
-
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42﹣、NO3﹣、Cl﹣中的4种离子,所含离子的物质的量均为1mol.若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42﹣、NO3﹣
难度: 困难查看答案及解析
-
短周期主族元素A、B、C、D的原子序数依次增大,并且A、B、C原子的最外层电子数之和为12,B、C、D位于同一周期,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的3倍。下列说法正确的是( )
A. 元素A、C的最高价氧化物对应的水化物都是弱酸
B. 元素B能与A的最高价氧化物发生置换反应
C. 元素B和D能形成BD2型的共价化合物
D. D的单质有毒,且有漂白性
难度: 中等查看答案及解析
-
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M === NiOOH + MH
已知:6NiOOH + NH3 + H2O + OH-==6 Ni(OH)2 + NO2-
下列说法正确的是( )
A.充电过程中OH- 离子从阳极向阴极迁移
B.充电过程中阴极的电极反应式:H2O + M + e-=MH + OH-,H2O中的H被M还原
C. 电池放电过程中,正极电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH-
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
难度: 困难查看答案及解析
-
加热N2O5依次发生的分解反应为:①N2O5(g)
N2O3(g)+O2(g);②N2O3(g)
N2O(g)+O2(g)在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为( )
A.10.7 B. 8.5 C. 9.6 D. 10.2
难度: 中等查看答案及解析
-
某化学研究小组探究外界条件对化学反应mA(g)+nB(g)
pC(g)的速率和平衡的影响图象如下,下列判断正确的是( )

A. 由图1可知,T1<T2,该反应正反应为吸热反应
B. 由图2可知,该反应m+n<p
C. 图3中,表示反应速率v正>v逆的是点3
D. 图4中,若m+n=p,则a曲线一定使用了催化剂
难度: 困难查看答案及解析
-
有关下图所示化合物的说法不正确的是 ( )

A. 既可以与Br2的CCl4溶液发生加成反应,又可以在光照下与Br2发生取代反应
B. 1mol该化合物最多可以与3molNaOH反应
C. 既可以催化加氢,又可以使酸性KMnO4溶液褪色
D. 既可以与FeCl3溶液发生显色反应,又可以与NaHCO3溶液反应放出CO2气体
难度: 中等查看答案及解析
-
25℃时,在10mL浓度均为0.1mol•L﹣1的NaOH和NH3•H2O混合溶液中滴加0.1mol•L﹣1盐酸,下列有关溶液中粒子浓度关系正确的是( )
A. 未加盐酸时:c(OH﹣)>c(Na+)=c(NH3•H2O)
B. 加入10mL盐酸时:c(NH4+)+c(H+)=c(OH﹣)
C. 加入盐酸至溶液pH=7时:c(Cl﹣)=c(Na+)
D. 加入20mL盐酸时:c(Cl﹣)=c(NH4+)+c(Na+)
难度: 中等查看答案及解析
-
铜镁合金1.52g完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
A. 该合金中铜与镁的物质的量之比是2:1
B. 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C. NO2和N2O4的混合气体中,NO2的体积分数是80%
D. 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
难度: 困难查看答案及解析
-
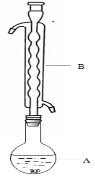
某电源装置如图所示,电池总反应为2Ag+Cl2═2AgCl.下列说法正确的是( )

A. 正极反应为AgCl+e﹣═Ag+Cl﹣
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01mol e﹣时,交换膜左则溶液中约减少0.02mol离子
难度: 困难查看答案及解析
-
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=﹣lgc(M),p(CO32﹣)=﹣lgc(CO32﹣).下列说法正确的是( )
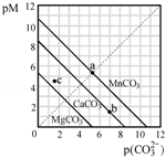
A. MgCO3、CaCO3、MnCO3的Ksp依次增大
B. a 点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32﹣)
C. b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32﹣)
D. c 点可表示MgCO3的不饱和溶液,且c(Mg2+)>c(CO32﹣)
难度: 困难查看答案及解析