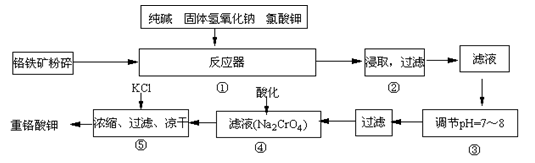
-
NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下,21g氧气和27g臭氧所含氧原子总数为3NA
B.34 g H2O2中含阴离子数为NA
C.饱和FeCl3溶液加入沸水中,若有1mol FeCl3水解,可生成NA个胶体粒子
D.80mL 10mol/L浓盐酸与足量MnO2加热反应,转移电子数为0.4NA
难度: 中等查看答案及解析
-
在下列各指定溶液中,离子可能大量共存的是
A.澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl-
B.使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl-
C.含有大量ClO-的溶液中:K+、OH-、I-、SO32-
D.c(Fe3+)=0.1mol/L的溶液中: K+、ClO-、SO42-、SCN-
难度: 中等查看答案及解析
-
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
被提纯的物质
除杂试剂
分离方法
A
溴化钠溶液(NaI)
氯水、CCl4
萃取、分液
B
CO(CO2)
饱和NaHCO3溶液
洗气
C
FeSO4(Fe2(SO4)3)
足量铁屑
过滤
D
CO2(SO2)
NaOH
洗气
难度: 中等查看答案及解析
-
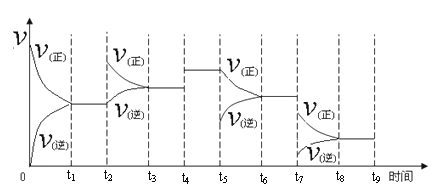
将0.1mol Cu与40ml 10mol/LHNO3充分反应,测得反应后的溶液里含有a molH+由此可知
A.生成的气体一定是NO2,在标准状况下的体积4.48 L
B.生成的气体一定是NO,在标准状况下的体积约1.49L
C.被还原的硝酸的物质的量为(0.2-a)mol
D.反应后的溶液里含有0.2mol NO3-
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.AgCl不溶于稀硝酸,但可溶于氨水中:
AgCl +2 NH3·H2O = [Ag(NH3)2]++ Cl-+2H2O
B.双氧水中滴加酸性高锰酸钾,溶液紫红色褪去:
6H++ 2MnO4- + H2O2= 2Mn2+ + 3O2 ↑+ 4H2O
C.在硫酸亚铁溶液中通入氧气:4Fe2++O2+2H2O= 4Fe3++4 OH-
D.乙炔气体中混有的硫化氢,可通过盛有CuSO4溶液的洗气瓶:Cu2+ + S2- = CuS↓
难度: 中等查看答案及解析
-
下列化学实验事实及其解释都正确的是
A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1mol/L稀硫酸反应
B.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
C.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强
D.工业制玻璃的主要反应之一:高温下Na2CO3+SiO2=Na2SiO3+CO2↑该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
难度: 中等查看答案及解析
-
下列选项中哪一种可与陶瓷、普通玻璃、水泥归为同种类型的材料
A.铝合金 B.高温结构氮化硅陶瓷
C.有机玻璃 D.砖瓦
难度: 中等查看答案及解析
-
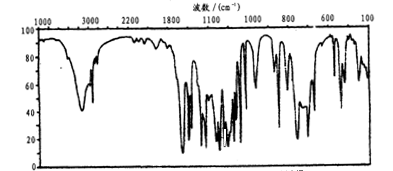
化学科学需要借助化学专用语言来描述,下列有关化学用语表示正确的是
A.S2-的结构示意图: B. N2的电子式:
C.次氯酸的结构式:H—O—Cl D.氢氧化钠的电子式:
难度: 中等查看答案及解析
-
下列反应中,产物不会随反应物量的改变而改变的是
A.钠与氧气 B.稀硫酸与铝片
C.二氧化硫与氨水 D.稀硝酸与铁粉
难度: 中等查看答案及解析
-
某溶液中可能含有I-、NH4+、Cu2+、SO32-,向溶液中加入少量溴水,溶液呈无色。
(提示:I2+SO2+2H2O==2HI+H2SO4)则下列关于溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-
A.①② B.①③ C.②③④ D.①②③
难度: 中等查看答案及解析
-
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
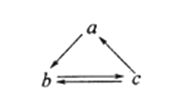
物质
选 项
a
b
c
A
NO
NO2
HNO3
B
Na2SiO3
Si
SiO2
C
HCl
HClO
Cl2
D
S
SO2
SO3
难度: 中等查看答案及解析
-
一些烷烃的燃烧热如下表:
化合物
燃烧热/kJ·mol-1
化合物
燃烧热/kJ·mol-1
甲烷
891.0
正丁烷
2878.0
乙烷
1560.8
异丁烷
2869.6
丙烷
2221.5
异戊烷
3531.3
下列表达正确的是
A.正戊烷的燃烧热大于3531.3kJ·mol-1
B.稳定性:正丁烷>异丁烷
C.乙烷燃烧的热化学方程式为:
2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ;△H= -1560.8 kJ·mol-1
D.相同物质的量的烷烃CnH2n+2,n越大,燃烧放出的热量越多
难度: 中等查看答案及解析
-
下列有关物质检验的操作和实验结论都正确的是
选项
实 验 操 作 及 现 象
实 验 结 论
A
向某溶液中先加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解
该溶液中一定含有SO42-
B
向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色
该溶液中一定含有Fe2+
C
将某气体通入品红溶液中,品红溶液褪色
该气体一定是SO2
D
向某溶液加入NaOH并微热,产生的无色气体能够使湿润的红色石蕊试纸变蓝。
该溶液中一定含有NH4+
难度: 中等查看答案及解析
-
某学习小组拟利用如下装置制备氮化钙(化学式:Ca3N2 ,极易与H2O反应)
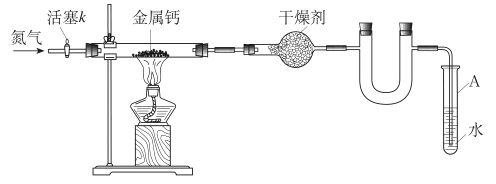
下列说法正确的是
A.打开活塞K通入N2,试管A内有气泡产生,说明装置气密性良好
B.U形管中盛放的干燥剂既可以用碱石灰,也可以用浓硫酸
C.反应结束后,先熄灭酒精灯,待反应管冷却后再关闭活塞K
D.将产物Ca3N2放入盐酸中,只能得到一种盐
难度: 中等查看答案及解析