-
氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
① 一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t4 ________t5 ________ t7________。
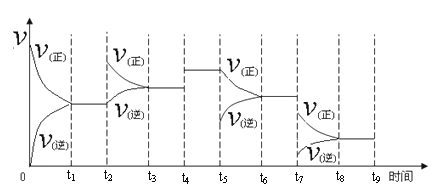
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为________。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) + H2O(g)  H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
①该反应在低温下不能自发进行的原因是________。
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度 ( )
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ
D.Ⅰ、Ⅲ和Ⅳ E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol碘化氢(a>b)待反应:2HI(g) H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
-
氨气是一种重要的物质,可用于制取化肥和硝酸等.
(1)工业合成氨的热化学方程式:N2(g)+3H2(g)⇌2NH3(g);△H=-92.2KJ/mol.有关键能: :946.5KJ/mol;N-H:391.0KJ/mol;则H-H键能为______.
:946.5KJ/mol;N-H:391.0KJ/mol;则H-H键能为______.
(2)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得.部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:已知1molH2O(g)转变为1molH2O(l)时放热44.0KJ.写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式______.
| 物质 | △H(KJ/mol) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
(3)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是______,溶液中离子浓度从大到小的顺序是______.
-
(14分)氨气是一种重要的物质,可用于制取化肥和硝酸等。
(1)氨气催化氧化的化学方程式为________。
 (2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
(2)工业合成氨的热化学方程式为:N2(g)+3H2(g) 2NH3(g);△H=-92.2kJ/mol。
有关键能:N=N945.6kJ/mol N-H391.0kJ/mol,则H—H键能为________。
(3)500°C、50Mpa时,在容积为VL的定容器中加入n mol N2、3n mol H2,反应达到平衡后N2的转化率为a。则容器内气体的压强反应前与平衡时的比值为________。
(4)合成氨原料中的H2可用甲烷在高温下与水蒸气反应制得。部分1mol物质完全燃烧生成常温下稳定氧化物的△H数据如下表:
| 物质 | △H(kJ/mol) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1 mol H2O(g)转变为1molH2O(l)时放热44.0kJ。写出CH4和水蒸气在高温下反应得到CO和H2的热化学方程式________。
(5)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl—NH4Cl为电解质溶液制取新型燃料电池。写出该电池的正极反应式________。
(6)若把标准状况下6.72L氨气通入到100g19.6%的硫酸溶液中,所得溶液中的溶质是
________,溶液中离子浓度从大到小的顺序是________。
-
氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
工业合成氨的化学方程式:N2 + 3H2 2NH3 +92.4KJ
2NH3 +92.4KJ
(1)它是氮的固定的一种,属于_____________( 选填“大气固氮”、“生物固氮” “人工固氮”);若升高温度,该平衡向____________方向移动(选填“正反应”或“逆反应”)。
(2)该反应达到平衡状态的标志是______________。(选填编号)
a.压强不变 b.v正(H2)= v正(NH3) c.c (N2)不变 d.c(NH3)= c(N2)
(3)欲使NH3产率增大,可采取的措施有_____________、____________。若容器容积为2L,开始加入的N2为0.1mol,20s后测得NH3的物质的量为0.08mol,则N2的平均反应速率为_________________________________________mol/(L∙S)。
(4)如右图所示,将集有氨气的试管倒置于水槽中,观察到试管内液面上升,溶液变为红色,解释发生该现象的原因____________________________________。
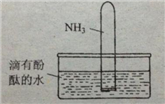
(5)(NH4)2SO4是常用的氮肥,长期施用时会使土壤酸化板结,
用离子方程式表示原因___________________________________
检验(NH4)2SO4含NH4+的方法是_______________________________。
___________________________________________________.
-
合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为N2(g)+3H2(g) 2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
2NH3(g) ΔH=-92.2 kJ·mol-1。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷或焦炭与水蒸气反应制得。
(1)在一容积固定的密闭容器中注入N2和H2两种气体,发生上述反应,在某温度下达到平衡时,各物质的浓度分别是:c(H2)=9.00 mol·L-1,c(N2)=3.00 mol·L-1,c(NH3)=4.00 mol·L-1,此温度下该反应的平衡常数K=________。
(2)在三个相同容器中各充入1 mol N2和3 mol H2,在不同条件下反应并达到平衡,氨的体积分数随时间变化的曲线如图所示。下列说法中正确的是________(填字母)。
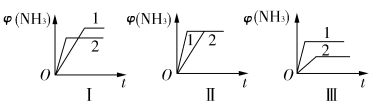
A.图Ⅰ可能是不同压强对反应的影响,且p2>p1
B.图Ⅱ可能是不同压强对反应的影响,且p1>p2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
(3)将水蒸气通过红热的炭即可产生水煤气,化学方程式为:C(s)+H2O(g)=H2(g)+CO(g)
ΔH=+131.3 kJ·mol-1,ΔS=+133.7J·K-1 ·mol-1
该反应在常温下能否自发进行?________(填“能”或“不能”)。
-
(12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g)  2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
2NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用甲烷在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。
回答下列问题:
(1)合成氨工业中原料气压缩到30~50MPa的原因是________。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是________。
(2)500℃、50MPa时,在容积为VL的容器中加入n mol N2、3n mol H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=________。
(3)甲烷在高温下与水蒸气反应反应方程式为:CH4(g)+H2O(g)=CO(g)+3H2(g)。部
分物质的燃烧热数据如下表:
| 物 质 | 燃烧热(kJ·mol-1) |
| H2(g) | -285.8 |
| CO(g) | -283.0 |
| CH4(g) | -890.3 |
已知1mol H2O(g)转变为1mol H2O(l)时放出44.0 kJ热量。写出CH4和H2O(g)在高温下反应的热化学方程式________。
(4)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。请写出该电池的正极反应式________。
-
工业上合成氨的反应如下:N2(g) + 3H2(g) 2NH3(g),以下措施中,既能加快反应速率,又能增大氢气转化率的是
2NH3(g),以下措施中,既能加快反应速率,又能增大氢气转化率的是
A. 升高温度 B. 增大容器体积 C. 移走氨气 D. 增加氮气
-
工业上合成氨的反应如下:N2(g) + 3H2(g) 2NH3(g)+Q,以下措施中,既能加快反应速率,又能增大氢气转化率的是
2NH3(g)+Q,以下措施中,既能加快反应速率,又能增大氢气转化率的是
A. 升高温度 B. 增大容器体积 C. 移走氨气 D. 增加氮气
-
氨是生产氮肥、尿素等物质的重要原料。
(1)合成氨反应N2(g) + 3H2(g) 2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
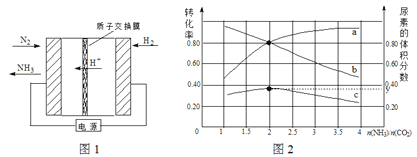
(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(3)废水中含氮化合物的处理方法有多种。
①NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N20.672 L(标准状况),则需要消耗0.3mol·L-1的NaClO溶液 L。
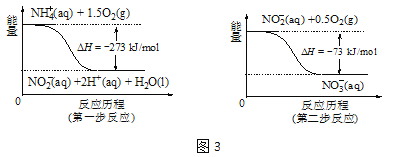
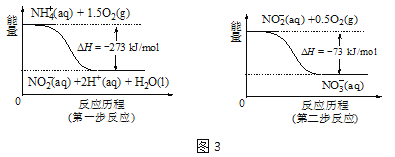
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图3所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是 kJ。
③用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
-
氨是生产氮肥、尿素等物质的重要原料。
(1)合成氨反应N2(g) + 3H2(g) 2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
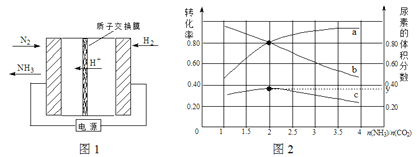
(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(3)废水中含氮化合物的处理方法有多种。
①NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N20.672 L(标准状况),则需要消耗0.3mol·L-1的NaClO溶液 L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图3所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是 kJ。
③用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
2NH3(g);ΔH = -92.2 kJ·mol-1。

H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)





