-
氨是生产氮肥、尿素等物质的重要原料。
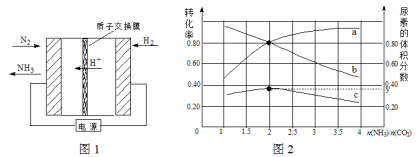
(1)合成氨反应N2(g) + 3H2(g) 2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
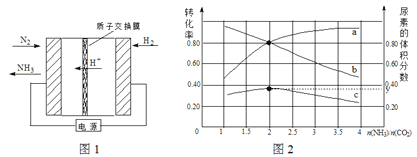
(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(3)废水中含氮化合物的处理方法有多种。
①NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N20.672 L(标准状况),则需要消耗0.3mol·L-1的NaClO溶液 L。
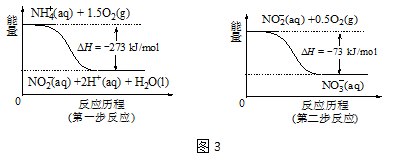
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图3所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是 kJ。
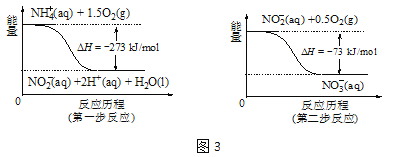
③用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
-
氨是生产氮肥、尿素等物质的重要原料。
(1)合成氨反应N2(g) + 3H2(g) 2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
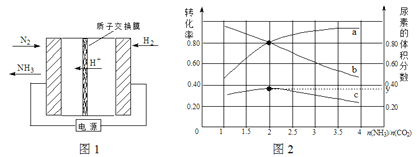
(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(3)废水中含氮化合物的处理方法有多种。
①NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N20.672 L(标准状况),则需要消耗0.3mol·L-1的NaClO溶液 L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图3所示。则1 mol NH4+(aq)全部被氧化成NO3-(aq)时放出的热量是 kJ。
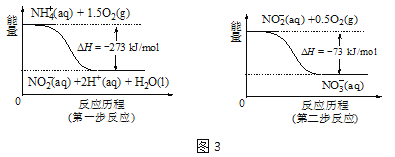
③用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
-
氨是生产氮肥、尿素等物质的重要原料。
(1)合成氨反应N2(g) + 3H2(g) 2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g) CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
(3)废水中含氮化合物的处理方法有多种。
①NaClO溶液可将废水中的NH4+转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液 L。
②在微生物的作用下,NH4+经过两步反应会转化为NO3-,两步反应的能量变化如图3所示。则1 mol NH4+ (aq)全部被氧化成NO3- (aq)时放出的热量是 kJ。
③用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
-
合成氨然后再生产尿素是最重要的化工生产。
I.在3个2 L的密闭容器中,在相同的温度下、使用相同的催化剂分别进行反应:
3H2(g) + N2(g) 2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
2NH3(g),按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时有关数据如下:
|  容器 容器
| 甲 | 乙 | 丙 |
| 反应物投入量 | 3 mol H2、2 mol N2 | 6 mol H2、4mol N2 | 2 mol NH3 |
| 达到平衡的时间/min | | 5 | 8 |
| 平衡时N2的浓度/mol·L-1 | c1 | 1.5 | |
| NH3的体积分数 | ω1 | | ω3 |
| 混合气体密度/g·L-1 | ρ1 | ρ2 | |
(1)容器乙中反应从开始到达平衡的反应速率为v(H2)=___________。
(2)在该温度下甲容器中反应的平衡常数K=________(用含c1的代数式表示)。
(3)分析上表数据,下列关系正确的是________(填序号):
a.2c1 > 1.5 b.2ρ1 = ρ2 c.ω3 = ω1
II.工业上用氨气合成尿素(H2NCONH2)的反应在进行时分为如下两步:
第一步:2NH3(l)+CO2(g) H2NCOONH4 (l) (氨基甲酸铵) △H1
H2NCOONH4 (l) (氨基甲酸铵) △H1
第二步:H2NCOONH4(l) H2O(l)+H2NCONH2(l) △H2
H2O(l)+H2NCONH2(l) △H2
(4)某实验小组模拟工业上合成尿素的条件,在一体积为0.5 L密闭容器中投入4 mol氨和1mol二氧化碳,实验测得反应中各组分随时间的变化如左下图I所示:
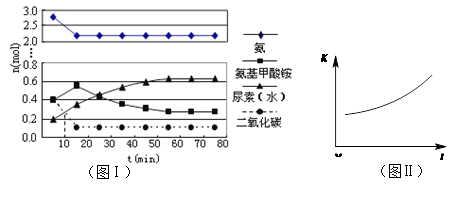
①已知总反应的快慢由慢的一步决定,则合成尿素总反应的快慢由第________步反应决定。
②第二步反应的平衡常数K随温度T的变化如右上图II所示,则△H2 ________ 0;③若第一步反应升温时氨气浓度增大,请在图II中画出第一步反应K1随温度T变化曲线,并作出必要的标注。
(5)氨和尿素溶液都可以吸收硝工业尾气中的NO、NO2,将其转化为N2。
①尿素与NO、NO2三者等物质的量反应为:CO(NH2)2+NO+NO2 =CO2+2N2+2H2O
该反应中的氧化剂为________(写化学式)。
②已知:N2(g)+O2(g)= 2NO(g) △H =a kJ·mol-1
N2(g)+3H2(g)= 2NH3(g) △H2=bkJ· kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = c kJ·mol-1
则4NH3(g) +4NO(g) +O2(g)= 4N2(g)+6H2O(g) △H=________。
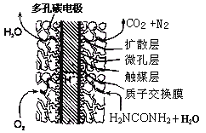
③尿素燃料电池结构如下图所示。其工作时负极电极反应式可表示为________。
-
氨是生产氮肥、尿素等物质的重要原料。电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
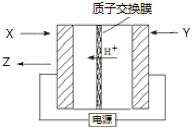
A.图中所示物质中,X为H2,Y为N2
B.Y参与的电极反应为H2+2e—=2H+
C.当有3g H+通过质子交换膜时,Z的体积为22.4L
D.反应过程中左边区域溶液pH逐渐升高
-
氨是生产氮肥、尿素等物质的重要原料。电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )
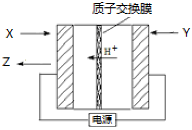
A.图中所示物质中,X为H2,Y为N2
B.Y参与的电极反应为H2+2e—=2H+
C.当有3g H+通过质子交换膜时,Z的体积为22.4L
D.反应过程中左边区域溶液pH逐渐升高
-
氨是生产氮肥、尿素等物质的重要原料。电化学法是合成氨的一种新方法,其原理如图所示,下列有关说法正确的是( )

A.图中所示物质中,X为H2,Y为N2
B.Y参与的电极反应为H2+2e—=2H+
C.当有3g H+通过质子交换膜时,Z的体积为22.4L
D.反应过程中左边区域溶液pH逐渐升高
-
氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
工业合成氨的化学方程式:N2 + 3H2 2NH3 +92.4KJ
2NH3 +92.4KJ
(1)它是氮的固定的一种,属于_____________( 选填“大气固氮”、“生物固氮” “人工固氮”);若升高温度,该平衡向____________方向移动(选填“正反应”或“逆反应”)。
(2)该反应达到平衡状态的标志是______________。(选填编号)
a.压强不变 b.v正(H2)= v正(NH3) c.c (N2)不变 d.c(NH3)= c(N2)
(3)欲使NH3产率增大,可采取的措施有_____________、____________。若容器容积为2L,开始加入的N2为0.1mol,20s后测得NH3的物质的量为0.08mol,则N2的平均反应速率为_________________________________________mol/(L∙S)。
(4)如右图所示,将集有氨气的试管倒置于水槽中,观察到试管内液面上升,溶液变为红色,解释发生该现象的原因____________________________________。
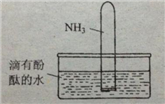
(5)(NH4)2SO4是常用的氮肥,长期施用时会使土壤酸化板结,
用离子方程式表示原因___________________________________
检验(NH4)2SO4含NH4+的方法是_______________________________。
___________________________________________________.
-
氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
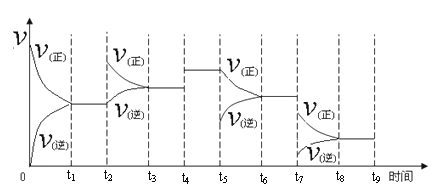
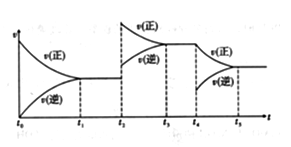
① 一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t4 ________t5 ________ t7________。
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为________。
(2)工业上大量的氢气来源于焦炭与水蒸气高温下的反应:
C(s) + H2O(g)  H2(g) + CO(g) △H = +131.3 kJ/mol
H2(g) + CO(g) △H = +131.3 kJ/mol
①该反应在低温下不能自发进行的原因是________。
②恒温,在容积可变的密闭容器中,进行如上可逆反应。一段时间后,下列物理量不发生变化时,能表明该反应已达到平衡状态的有:Ⅰ混合气体的密度;Ⅱ容器内气体的压强;Ⅲ混合气体的总物质的量; ⅣCO物质的量浓度 ( )
A.只有Ⅳ B.只有Ⅰ和Ⅳ C.只有Ⅱ和Ⅲ
D.Ⅰ、Ⅲ和Ⅳ E.都可以
(3)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入amol及bmol碘化氢(a>b)待反应:2HI(g) H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
-
氨是合成硝酸、铵盐和氮肥的基本原料,在科学技术和生产中有重要的应用。请回答下列问题:
(1)以N2和H2为原料,合成氨气的反应为N2(g)+3H2(g)  2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是_____________ (填序号)。
2NH3(g) ΔH<0,下列措施可以提高ʋ(正)的是_____________ (填序号)。
a.选择适当的催化剂 b.增大压强
c.及时分离生成的NH3 d.降低温度
(2)在恒温条件下,将N2与H2按一定比例混合的气体充人一个体积可变的恒压密闭容器中,p = 5MPa,原气体体积为2L。5分钟后反应达到平衡时,n(N2)=1.0mol,n(H2)=3.0mol,n(NH3)=1.0mol,则反应速率v (N2)=_______mol/min (用单位时间物质的量变量表示化学反应速率),平衡常数Kp =________。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)在容积恒定的密闭容器中进行反应2NO(g)+O2(g)  2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是_____ (填序号)。
2NO2(g) ΔH>0,该反应的反应速率(v)随时间(t)变化的关系如图所示。若t2、t4时刻只改变一个条件,下列说法正确的是_____ (填序号)。
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时的值最大
(4)氨和联氨(N2H4)是氨的两种常见化合物,最常见的制备联氨的方法是以丙酮为催化剂,用次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2 :1,写出该反应的化学方程式:_________。标况下,每消耗1.12L氨气,转移_________mol电子。
(5)已知:N2(g)+O2(g)═2NO(g) ΔH=+180.5Kj/mol; N2(g)+3H2(g)  2NH3(g)
2NH3(g)
ΔH=-92.4kJ/mol; 2H2(g) +O2 (g) ═2H2O(g) ΔH=-483.6kJ/mol。
若有34g氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为_________。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。

CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。












