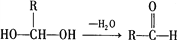-
分类是科学研究的重要方法,讨论辨析以下说法:①漂白粉、铝热剂、粗盐都是混合物;②酸性氧化物都是非金属氧化物;③胆矾和干冰既是纯净物又是化合物;④不锈钢和目前流通的硬币都是合金;⑤油脂、淀粉、蛋白质既是营养物质又是高分子化合物;⑥乙醇、四氯化碳、氯气、葡萄糖都是非电解质;⑦豆浆和雾都是胶体。上述说法正确的是
A. ①②③④ B. ①③④⑦ C. ①②⑤⑥ D. ③⑤⑥⑦
难度: 简单查看答案及解析
-
查看葡萄酒标签上的成分信息时,常发现其成分中含有少量SO2 。下列关于SO2说法正确的是
A. SO2属于非法添加剂,不该添加到葡萄酒中
B. SO2具有还原性,不能用浓硫酸干燥
C. SO2具有还原性,少量的SO2可防止葡萄酒氧化变质
D. SO2可以使酸性KMnO4溶液褪色,体现了它的漂白性
难度: 困难查看答案及解析
-
下列措施不合理的是
A. 用SO2漂白纸浆和草帽辫
B. 用硫酸清洗锅炉中的水垢
C. 高温下用焦炭还原SiO2制取粗硅
D. 用Na2S作沉淀剂,除去废水中Cu2+和Hg2+
难度: 中等查看答案及解析
-
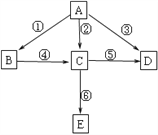
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如图的转化关系(部分产物及反应条件已略去): 下列判断正确的是:
A. X元素一定为非金属元素
B. X元素可能为Al
C. 反应①和②互为可逆反应
D. 反应①和②不一定为氧化还原反应
难度: 困难查看答案及解析
-
将锌、铁、铜粉末按一定比例混合投入到一定量的硝酸中,微热、充分反应后,过滤,弃掉滤渣,滤液中金属离子情况不可能是
A. 只含Cu2+、Fe3+、Zn2+ B. 只含Zn2+
C. 只含Zn2+、Fe2+ D. 只含Cu2+、Fe2+、Zn2+
难度: 简单查看答案及解析
-
用下列装置进行相应实验,能达到实验目的的是
A. 图1所示装置用于Cu和浓H2SO4反应制取少量的SO2气体
B. 图2所示装置用于除去碳酸氢钠固体中的少量碳酸钠
C. 图3所示装置配制100 mL 0.1 mol·L-1的硫酸
D. 图4所示装置用于分离出溴苯
难度: 中等查看答案及解析
-
工业上通过反应“SiO2+2C
Si+2CO↑”制取单质硅,下列说法正确的是
A. 自然界中硅元素均以SiO2形式存在
B. 高纯度晶体Si可用于制造光导纤维
C. 该反应条件下C的还原性比Si强
D. 标准状况下生成4.48 L CO时转移电子数为0.4×6.02×1023
难度: 困难查看答案及解析
-
在下列条件下,可能大量共存的微粒组是:
A. 能与Al反应生成H2的溶液:NH4+、Ca2+、NO3-、I-
B. 水溶液中:HClO、HCO3-、ClO-、CO32-
C. c(H+)=1×10-14mol/L的溶液:K+、Na+、AlO2-、CO32-
D. 中性的溶液中:CO32-、Na+、SO42-、AlO2-
难度: 困难查看答案及解析
-
阿伏加德罗常数约为6.02×1023mol﹣1,下列说法中正确的是( )
A. 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023
B. 1L lmol.L﹣1FeBr2溶液与l mol氯气反应时转移的电子数为3NA
C. 标准状况下,11.2L HF所含的分子数约为3.01×1023
D. 0.5mol.L﹣1硫酸钠溶液中含有溶质离子总数为1.5NA
难度: 中等查看答案及解析
-
下列除去杂质的方法,正确的是
A. 除去碳酸氢钠固体中的少量碳酸钠:充入足量二氧化碳
B. CuCl2溶液中含有FeCl3杂质:加入过量氧化铜粉末,过滤
C. 提取溴水中的溴:用乙醇萃取后分液
D. CO2中含有HCl杂质:通入饱和Na2CO3溶液,洗气
难度: 困难查看答案及解析
-
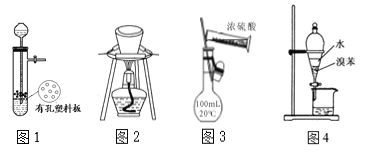
将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是
A. 若M(甲)>M(乙),则气体体积:甲<乙
B. 若M(甲)>M(乙),则气体的摩尔体积:甲<乙
C. 若M(甲)<M(乙),则气体的压强:甲>乙
D. 若M(甲)<M(乙),则的分子数:甲<乙
难度: 困难查看答案及解析
-
向氯酸钠的酸性水溶液中通入二氧化硫,反应中氧化过程为:SO2+2H2O–2 e-→SO42-+4H+;向亚氯酸钠(NaClO2)固体中通入用空气稀释的氯气,反应中还原过程为:Cl2 + 2 e- → 2Cl-。在上述两个反应中均会生成产物X,则X的化学式为
A. NaClO B. NaClO4 C. HClO D. ClO2
难度: 困难查看答案及解析
-
下列离子方程式书写正确的是
A. 用Pt电极电解少量的MgC12溶液:2H2O+2Cl-
H2↑+C12↑+2OH-
B. 明矾溶液中加入Ba(OH)2溶液至生成的沉淀的质量最多:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
C. 向含有4 mol FeBr2的溶液中通入3 mol Cl2充分反应:2Fe2++4Br-+3Cl2=4Fe3++6Cl-+2Br2
D. 将1 mol Fe投入到含3 mol H NO3的稀硝酸溶液中:6Fe + 5NO3- + 20H+ =3Fe2+ +3Fe3+ + 11NO↑ +10H2O
难度: 困难查看答案及解析
-
如图是金属镁和卤素单质(X2)反应的能量变化示意图。
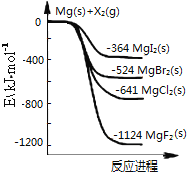
下列说法正确的是
A. 卤素单质(X2)与水反应均可生成两种酸
B. 用电子式表示MgF2的形成过程为:
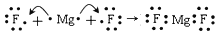
C. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
D. 由图可知此温度下MgI2(s)与Cl2(g)反应的热化学方程式为:MgI2(s)+Cl2(g)=MgCl2(s)+I2(g),ΔH=-277kJ·mol-1
难度: 中等查看答案及解析
-
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加b mol/L NaOH溶液,当滴加到V mL时,得到沉淀质量恰好为最大值n克,则下列有关该实验的说法中正确的有
①沉淀中氢氧根的质量为(n-m)g
②恰好溶解后溶液中的NO3-的物质的量为
mol
③反应过程中转移的电子的物质的量为
mol
④生成NO气体的体积在标准状况下为
L
⑤与合金反应的硝酸的物质的量为
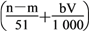 mol
molA. 5项 B. 4项 C. 3项 D. 2项
难度: 极难查看答案及解析
-
将一定体积的CO2通入V L NaOH溶液中,已知NaOH完全反应,若在反应后的溶液中加入足量石灰水,得到a g沉淀;若在反应后的溶液中加入足量CaCl2溶液,得到b g沉淀,则下列说法正确的是
A. 参加反应的CO2体积为0.224a L
B. 用上述数据不能确定NaOH溶液的物质的量浓度
C. 若a=b,则CO2与NaOH溶液反应的产物盐只有Na2CO3
D. b可能等于a、小于a或大于a
难度: 简单查看答案及解析
-
向13.6 g由Cu和Cu2O组成的混合物中加入一定浓度的稀硝酸250 mL,当固体物质完全溶解后生成Cu(NO3)2和NO气体。在所得溶液中加入0.5 mol·L-1的NaOH溶液1.0 L,生成沉淀质量为19.6 g,此时溶液呈中性且金属离子已完全沉淀。下列有关说法正确的是:
A. 原固体混合物中Cu与Cu20的物质的量之比为1:1
B. Cu、Cu2O与硝酸反应后剩余的HNO3为0.1 mol
C. 产生的NO的体积在标准状况下为3.36 L
D. 原稀硝酸中HNO3的物质的量浓度为1.6 mol·L-l
难度: 困难查看答案及解析
-
有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况下)与所加入的HCl的体积之间的关系如图所示:试分析:
(1)NaOH在吸收CO2气体后,在甲、乙 两种情况下,所得溶液中存在的溶质是
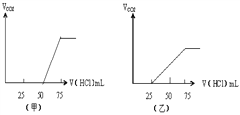
甲:_____________其物质的量之比是:__________
乙:_____________其物质的量之比是:__________
(2)在两种情况下产生的CO2气体(标准状况)各是甲:___________;乙:___________。
(3)原NaOH溶液的物质的量浓度是___________;
难度: 困难查看答案及解析