-
COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g)
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g)
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
分子
COS(g)
H2(g)
CO(g)
H2S(g)
H2O(g)
CO2(g)
能量/kJ·mol-1
1321
440
1076
680
930
1606
则X=_____________________。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________(保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3
H2S
Ka1
4.4× 10-7
1.3×10-7
Ka2
4.7× 10-11
7.1×10-15
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________。
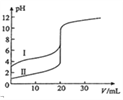
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-)与Igc(M2+)的关系如右图所示,请回答:

①25℃时Ksp(CuS)=_______________。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________mol/L。
难度: 困难查看答案及解析
-
黄铜矿是一种重要的化工原料,主要成分是CuFeS2,另外还有少量的氧化铝、二氧化硅及水分,通过化学工艺可获得许多化工产品。
(1)铜元素位于元素周期表中_________(填写周期、族);基态Fe原子的价层电子轨道表达式为_____;
(2)硫位于第VIA 族,该族元素氢化物沸点由低到高的顺序及原因是_________(必要化学用语及文字简答)。
(3)基态氮原子的第一电离能大于氧原子的第一电离能的原因是__________。
(4)由铝和氯元素组成的化合物熔点190℃、在熔融态不导电;该化合物易升华,其蒸气密度是相同条件下氢气的133.5倍。请写出其蒸气分子的结构式______________(如有配位键,请 用“→”表 示 )。(5)黄铜矿在空气中高温灼烧可以得到固体混合物和废气,固体混合物中有X和Y两化合物。固体化合物X的晶胞模型如图甲所示:

①化合物X的化学式:___________;
②废气中SO2经催化氧化生成SO3,SO3分子中硫原子杂化方式为___________;SO3分子空间构型是___________。
(6)黄铜矿高温灼烧得到的另一固体化合物Y的晶胞模型如图乙,已知丫晶体密度为ρg/cm3,则Y 晶体中晶胞边长是_____cm。
难度: 困难查看答案及解析
-
二氧化锆(ZrO2)是最重要的氧离子固体电解质,用于制造燃料电池、氧气含量测定仪等。可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2;含有少量Fe2O3、Al2O3、SiO2杂质)通过如工艺流程法制得。
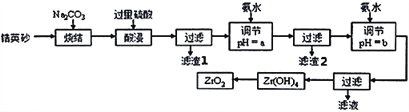
已知:①ZrO2具有两性,高温与纯碱共熔生成可溶于水的Na2ZrO3,与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子
Fe3+
Al3+
ZrO2+
开始沉淀时pH
1.9
3.3
6.2
沉淀完全时pH
3.2
5.2
8.0
请回答下列问题:
(1)已知Zr元素的原子序数是40,请写出它在周期表中的位置:____________________________。
(2)烧结时ZrSiO4发生反应的化学方程式为__________________________;滤渣1的化学式为__________。
(3)调节pH=a时,a的范围应该是__________________;用氨水调节pH=b时,所发生反应的离子方程式为_______________________________________。
(4)本题的流程中,一共有三步过滤操作,北中最后一步过滤所得的Zr(OH)4沉淀需要洗涤,证明该沉淀已经洗涤干净的最佳操作方法是:______________________________________。
(5)工业上用铝热法冶炼锆,写出以ZrO2通过铝热法制取锆的化学方程式:________________。
(6)一种新型燃料电池用掺杂Y2O3的ZrO2晶体作电解质在熔融状态下传导O2-,一极通入空气,另一极通入乙烷,写出负极的电极反应式:________________________________。
难度: 困难查看答案及解析
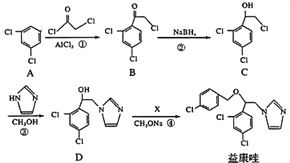
 CH3CH2OH
CH3CH2OH


 [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色) [Cu(NH3)4]2+ (蓝色)
[Cu(NH3)4]2+ (蓝色) 