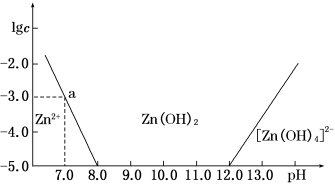
-
下列金属防腐的措施中,使用外加电流的阴极保护法的是
A.水中的钢闸门连接电源的负极 B.金属护栏表面涂漆
C.汽车底盘喷涂高分子膜 D.地下钢管连接镁块
难度: 简单查看答案及解析
-
合理利用某些盐能水解的性质,能解决许多生产、生活中的问题,下列叙述的事实与盐水解的性质无关的是
A.金属焊接时可用NH4Cl溶液作除锈剂
B.配制FeSO4溶液时,加入一定量Fe粉
C.长期施用铵态氮肥会使土壤酸化
D.向FeCl3溶液中加入CaCO3粉末后有气泡产生
难度: 中等查看答案及解析
-
COCl2(g)
CO(g)+ Cl2(g) ΔH>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④扩大容积 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
A.①②④ B.①④⑥ C.②③⑥ D.③⑤⑥
难度: 中等查看答案及解析
-
在298 K、101.325 kPa时发生下列反应:①2H2(g)+O2(g)=2H2O(l) ②CaO(s)+CO2(g)=CaCO3(s);其熵变分别为ΔS1和ΔS2,则下列情况中正确的是
A.ΔS1>0,ΔS2>0 B.ΔS1<0,ΔS2<0
C.ΔS1<0,ΔS2>0 D.ΔS1>0,ΔS2<0
难度: 简单查看答案及解析
-
下列事实中不能证明CH3COOH是弱电解质的是
①常温下某CH3COONa溶液的pH=8 ②用CH3COOH溶液做导电实验,灯泡很暗 ③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多 ④0.1mol/L的CH3COOH溶液的pH=2.1 ⑤pH=1的CH3COOH溶液稀释100倍,pH<3
A.② B.②⑤ C.①③⑤ D.③④⑤
难度: 中等查看答案及解析
-
反应N2(g)+3H2(g)
2NH3(g)△H<0在某一时间段中反应速率与反应过程的曲线关系如图,则图中氨的百分含量最低的时间段是
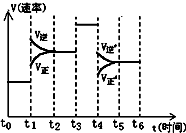
A.t0-t1 B.t2-t3 C.t3-t4 D.t5-t6
难度: 中等查看答案及解析
-
下列说法中正确的是
A.AgCl悬浊液中存在平衡:AgCl(s)
Ag+(aq)+Cl-(aq),往其中加入少量NaCl固体,平衡向左移动,溶液中离子的总浓度会减小
B.AgCl悬浊液中加入KI溶液,白色沉淀变成黄色,证明此条件下Ksp(AgCl)>Ksp(AgI)
C.饱和石灰水中加入一定量生石灰,温度明显升高,所得溶液的pH增大
D.硬水中含有较多的Ca2+、Mg2+、HCO3-、SO42-,加热煮沸可完全除去其中的Ca2+、Mg2+
难度: 中等查看答案及解析
-
电解NO制备NH4NO3,其工作原理如右图所示,下列说法不正确的是

A.b极的电极反应为:NO-3e-+4OH-=NO3-+2H2O
B.溶液中的H+由电极b处向电极a处迁移
C.电解过程总反应的化学方程式为:
8NO+7H2O
3NH4NO3+2HNO3
D.为使电解产物全部转化为NH4NO3,需补充的物质A是NH3
难度: 中等查看答案及解析
-
已知:CO(g) + FeO(s) =Fe(s)+CO2(g) ΔH=-218kJ/mol,则14 g CO气体还原足量FeO固体得到Fe固体和CO2气体时放出的热量为
A.+218 kJ/mol B.-109 kJ/mol C. 218 kJ D. 109 kJ
难度: 中等查看答案及解析
-
室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.溶液中
不变
C.醋酸的电离程度增大,溶液中c(H+)增大
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
难度: 中等查看答案及解析
-
在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示,又知t ℃时AgCl的Ksp=4×10-10。下列说法不正确的是
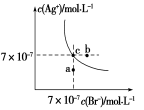
A.在t ℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)
AgBr(s)+Cl-(aq)平衡常数K≈816
难度: 中等查看答案及解析
-
某温度下向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中不正确的是
A.该温度高于25℃
B.由水电离出来的H+的浓度是1.0×10-10mol/L
C.NaHSO4晶体的加入抑制了水的电离
D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性
难度: 中等查看答案及解析
-
下列说法正确的是
A.100℃时,pH=10的NaOH溶液与pH=2的H2SO4溶液等体积混合,则两者恰好中和,溶液的pH=7
B.室温下,将pH=2的盐酸与pH=12的氨水等体积混合后,溶液中离子浓度大小关系为:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.室温下,pH=3的盐酸与pH=12的NaOH溶液按体积比1:10混合后,溶液pH=7
D.室温下,在pH=11的某溶液中,由水电离出的c(H+)可能为10-3mol/L或10-11mol/L
难度: 中等查看答案及解析
-
常温下,向100 mL 0.01 mol/L HA溶液中逐滴加入0.02 mol/L MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。下列说法中,不正确的是
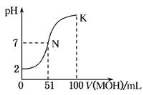
A.HA为一元强酸
B.MOH 为一元弱碱
C.N点水的电离程度小于K点水的电离程度
D.若K点对应溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005 mol/L
难度: 中等查看答案及解析
-
现有常温下的四种溶液:①pH=11的氨水、②0.001mol/L的NaOH溶液、③pH=3的醋酸、④由水电离出的c(H+)=10-11mol/L的盐酸。下列有关叙述正确的是
A.分别加水稀释10倍,四种溶液的pH:①>②>④>③
B.将③、④分别稀释到pH =5,由水电离出氢离子的浓度均减小100倍
C.在①、②中分别加入适量的氯化铵晶体后,①的pH减小,②的pH不变
D.将①、④两种溶液等体积混合,所得溶液中:c(OH-):c(H+)<1
难度: 困难查看答案及解析
-
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中正确的是(忽略混合前后溶液体积变化)
A.溶液的pH值:①>③>②
B.水电离出的c(OH-):③>①=②
C.①和③等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.1mol/L
D.②和③等体积混合后的溶液:c(Na+)=c(CH3COOH)+c(CH3COO-)
难度: 中等查看答案及解析
-
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是

A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况)被处理时,转移电子为0.4mol
难度: 中等查看答案及解析
-
用NaOH溶液滴定盐酸时,由于滴定速度太快,当混合溶液变红时不知NaOH是否过量,判断它是否过量的方法是
A.加入5mL盐酸再进行滴定 B.返滴一滴待测盐酸
C.重新进行滴定 D.以上方法均不适用
难度: 中等查看答案及解析
-
某实验小组以H2O2分解为例,探究浓度、催化剂、温度对反应速率的影响。按照如下方案完成实验。下列说法不正确的是
编号
反应物
催化剂
温度
①
10mL10% H2O2溶液
无
25℃
②
10mL20% H2O2溶液
无
25℃
③
10mL20% H2O2溶液
无
40℃
④
10mL20% H2O2溶液
1mL0.1mol/LFeCl3溶液
40℃
A.实验④反应速率最快
B.实验①反应速率最慢
C.实验②速率小于实验④的速率,只是因为实验④加入了催化剂
D.加入催化剂,能增大活化分子百分数,从而加快化学反应速率
难度: 中等查看答案及解析
-
在密闭容器中,5 mol H2与2 mol CO2发生反应:3H2(g)+CO2(g)
CH3OH(g)+H2O(g)。反应达到平衡时,改变温度(T)和压强(p),反应混合物中甲醇(CH3OH)的物质的量分数变化情况如下图所示。下列说法错误的是
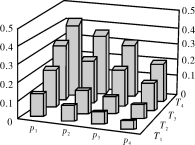
A.P1>P2>P3>P4
B.甲醇的物质的量分数越高,反应的平衡常数越大
C.若T1> T2> T3>T4,则该反应为放热反应
D.缩小容积,可以提高CH3OH在混合物中的质量分数
难度: 困难查看答案及解析
-
一定条件下存在反应:CO(g)+H2O(g)
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换)密闭容器I、II、III,在I中充入1molCO和1molH2O,在II中充入1molCO2和1mol H2,在III中充入2molCO和2molH2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO的物质的量比容器II中的少
D.容器I中CO的转化率与容器II中CO2的转化率之和小于1
难度: 困难查看答案及解析