-
化学与环境、材料、信息、能源关系密切,下列说法中不正确的是( )
A.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,既能杀菌消毒又能净水
B.“光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关
C.尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
难度: 中等查看答案及解析
-
其他条件不变,升高温度下列数据不一定增大的是( )
A.可逆反应的化学平衡常数K B.0.1 mol/L CH3COONa溶液的pH
C.水的离子积常数KW D.弱电解质的电离程度
难度: 中等查看答案及解析
-
室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2:CuSO4•5H2O受热分解的化学方程式为CuSO4•5H2O(s)
CuSO4(s)+5H2O(l),热效应为△H3,则下列判断正确的是( )
A.△H2>△H3 B.△H1<△H3
C.△H1+△H3=△H2 D. △H1+△H2>△H3
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.向0.1mol
CH3COOH溶液中加入少量水,溶液中
减小
B.将CH3COONa溶液从20℃升温至60℃,溶液中
增大
C.向盐酸中加入氨水至中性,溶液中
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
难度: 困难查看答案及解析
-
在恒容密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g)
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )
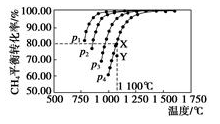
A.上述反应的△H>0 B.压强P1>P2>P3>P4
C.1100℃该反应的平衡常数为64 D.压强为P4时,在Y点:v(正)<v(逆)
难度: 困难查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X与W同主族,X、W的单质在标准状况下的状态不同。Y是空气中含量最高的元素,Z原子最外层电子数是其内层电子总数的3倍,Z2-与W+具有相同的电子层结构。下列说法正确的是
A. 原子半径大小顺序:r(W)>r(Z)>r(Y)>r(X)
B. 由X、Y、Z三种元素形成的化合物的水溶液可能呈碱性
C. 元素Y的简单气态氢化物的热稳定性比Z的强
D. 化合物X2Z2与W2Z2所含化学键类型完全相同
难度: 中等查看答案及解析
-
次磷酸(H3PO2)是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。下列有关说法正确的是
A.用惰性电极电解NaH2PO2溶液,其阳极反应式为:2H2O-4e-=O2↑+4H+
B.H3PO2与过量NaOH溶液反应的离子方程式为:H3PO2+3OH-=PO23-+3H2O
C.将H3PO2溶液加入到酸性重铬酸钾溶液中,H3PO2的还原产物可能为H3PO4
D.H3PO2溶于水的电离方程式为H3PO2
H++H2PO2-
难度: 困难查看答案及解析
-
下列有关实验装置的说法中正确的是
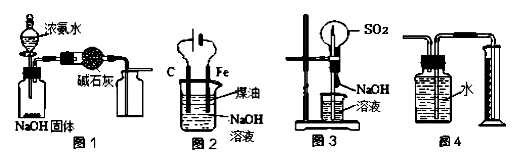
A.用图1装置制取干燥纯净的NH3
B.实验室可以用图2装置制备Fe(OH)2
C.用图3装置可以完成“喷泉”实验
D.用图4装置测量Cu与浓硝酸反应产生的NO2体积
难度: 中等查看答案及解析
-
下列说法正确的是
A.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B.加热0.1mol/LNa2CO3溶液,
CO32-的水解程度和溶液的pH均增大
C.1 L 1 mol•L―1的Na
ClO溶液中含有ClO―的数目为6.02×1023
D.相同条件下,溶液中Fe2+、Cu2+、Zn2+的氧化性依次减弱
难度: 中等查看答案及解析
-
下列图示与对应叙述相符的是
A.图甲表示压强对可逆反应2A(g)+2B(g)
3C(g)+D(s)的影响,乙的压强大
B.图乙表示CH3COOH溶液中通入NH3至过量的过程中溶液导电性的变化
C.图丙表明合成氨反应是放热反应,b表示在反应体系中加入了催化剂
D.图丁表示一定浓度Na2CO3溶液中滴加盐酸,生成CO2与滴加盐酸物质的量的关系
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO4↓+H++Cl-+ HClO
B.向FeCl2溶液加入足量NaClO溶液:6Fe2++3ClO-+3H2O=2Fe(OH)3↓+4Fe3++3Cl-
C.NH4HCO3溶液和过量的NaOH溶液混合:HCO
+OH-===CO
+H2O
D.向Fe(NO3)3溶液中加入足量的HI溶液:2Fe3++2I- = 2Fe2++I2
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在0.01mol·L-1Ba(OH)2溶液中:Al3+、NH4+、NO
、HCO
B.0.1mol/L的FeCl2溶液中:H+、Al3+、SO42-、ClO-
C.滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、I-
D.由水电离产生的c(H+)=1×10-13mol·L-1的溶液中:Na+、Ba2+、NO
、Cl-
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀
Ksp(AgCl)<Ksp(AgI)
B
向苯酚浊液中加入Na2CO3溶液,溶液变澄清
酸性:苯酚> HCO3—
C
向蓝色石蕊试纸上滴加新制氯水,试纸边缘呈红色、中间为白色[
氯水既有酸性又有还原性
D
淀粉与稀硫酸混和一段时间后,滴加银氨溶液并水浴加热,无银镜出现
淀粉没有水解
难度: 中等查看答案及解析
-
在密闭容器中进行反应:X(g)+3Y(g)
2Z(g),有关下列图像的说法正确的是( )
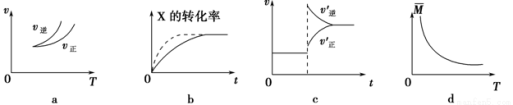
A.依据图a可判断正反应为吸热反应
B.在图b中,虚线可表示压强增大
C.若正反应的ΔH<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
难度: 困难查看答案及解析
-
利用控制n(H2S):n(FeCl3)=1:2反应得到的产物再用电解法制氢,其工作原理如图所示。下列有关的说法错误的是( )

A. 惰性电极a发生氧化反应
B. Fe(OH)3胶体中滴加溶液X,先有沉淀后沉淀溶解
C. 溶液Y加热蒸发灼烧最终得到Fe2O3
D. 电解池总反应的离子方程式为2Fe2++2H+
2Fe3++H2↑
难度: 困难查看答案及解析
-
下列说法正确的是 ( )
A.某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a
B.相同物质的量浓度的下列溶液中,①NH4Al(SO4)2、②(NH4)2SO4、③CH3COONH4、④NH3·H2O;c(NH4+)由大到小的顺序是:②>①>③>④
C.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(S2―)+c(HS―)+c(OH―)
D.AgCl悬浊液中存在平衡:AgC
l(s)
Ag+(aq)+Cl―(aq),往其中加入少量NaCl粉末,平衡会向左移动,Ksp减少
难度: 困难查看答案及解析