-
下列有关中和热的说法正确的是( )
A.表示中和热的热化学方程式:H+(l)+OH-(l)=H2O(l) ΔH=-57.3 kJ/mol
B.准确测量中和热的实验过程中,至少需测定温度4次
C.中和热的实验过程中,环形玻璃搅拌棒材料若用铜代替,则测量出的中和热数值偏小
D.已知2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol,则该反应的中和热为114.6 kJ/mol
难度: 中等查看答案及解析
-
已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A.-44.2 kJ·mol-1 B.+44.2 kJ·mol-1 C.-330 kJ·mol-1D.+330 kJ·mol-1
难度: 中等查看答案及解析
-
下列关于燃烧热的描述中正确的是( )
A.已知a g乙烯气体充分燃烧时生成1 mol CO2和液态水,放出b kJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)=4CO2(g)+4H2O(l) ΔH=-4b kJ·mol-1
B.将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+
O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1,则CH3OH(g)的燃烧热为192.9 kJ·mol-1
C.H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(g)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D.葡萄糖的燃烧热是2800kJ·mol-1,则
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l) ΔH=-1400kJ·mol-1
难度: 中等查看答案及解析
-
肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需能量(kJ)是( )
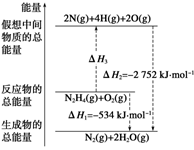
A.194 B.391 C.516 D.658
难度: 中等查看答案及解析
-
已知:①N2(g)+O2(g)=2NO(g) ΔH1=+180 kJ·mol-1
②N2(g)+3H2(g)
2NH3(g) ΔH2=-92.4 kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) ΔH3=-483.6 kJ·mol-1
下列说法正确的是( )
A.反应②中的能量变化如图所示,则ΔH2=E1-E3
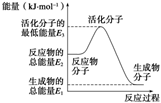
B.H2的燃烧热为241.8 kJ·mol-1
C.由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1
D.氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=+906 kJ·mol-1
难度: 中等查看答案及解析
-
在一定条件下,对于反应mA(g)+nB(g)
cC(g)+dD(g),C的百分含量(C%)与温度、压强的关系如图所示,下列该反应的ΔH和ΔS判断正确的是( )

A.ΔH<0 ΔS>0 B.ΔH>0 ΔS<0
C.ΔH>0 ΔS>0 D.ΔH<0 ΔS<0
难度: 中等查看答案及解析
-
SF6是一种优良的绝缘气体,分子结构中只存在S—F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F—F、S—F键需吸收的能量分别为160 kJ、330 kJ。则S(s)+3F2(g)=SF6(g)的反应热ΔH为( )
A.-1 780 kJ/mol B.-1 220 kJ/mol C.-450 kJ/mol D.+430 kJ/mol
难度: 中等查看答案及解析
-
乙酸蒸气能形成二聚分子2CH3COOH(g)
(CH3COOH)2 (g) Δ H<0 ,欲测定单体乙酸的相对分子质量,应采用的条件是( )
A.高温低压 B.低温高压 C.低温低压 D.高温高压
难度: 中等查看答案及解析
-
在密闭容器中进行反应CH4(g)+H2O(g)
CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是( )
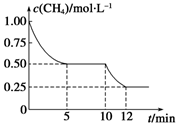
A.10 min时,改变的外界条件可能是升高温度
B.0~10 min内,v(H2)=0.15 mol·L-1·min-1
C.恒温下,缩小容器体积,一段时间内v逆>v正
D.12 min时,反应达平衡的本质原因是气体总质量不再变化
难度: 中等查看答案及解析
-
关节炎病因是在关节滑液中形成尿酸钠晶体,尤其在寒冷季节易诱发关节疼痛其化学机理为:
① HUr + H2O
Ur- + H3O+ ②Ur- (aq)+Na+(aq)
NaUr(s)
(尿酸) (尿酸根离子)
下列对反应②叙述中正确的是( )
A.反应的△H>0 B.反应的△H<0
C.升高温度平衡向正反应方向移动 D.改变温度不影响平衡移动
难度: 中等查看答案及解析
-
密闭容器中一定量的混合气体发生反应:xA(g)+yB(g)
zC(g),平衡时,测得A的浓度为0.50 mol/L,在温度不变时,把容器容积扩大到原来的2倍,使其重新达到平衡,A的浓度为0.30 mol/L,有关叙述不正确的是( )
A.平衡一定向右移动 B.B的转化率降低
C.x+y>z D.C的体积分数降低
难度: 困难查看答案及解析
-
在一体积可变的密闭容器中,加入一定量的X、Y,发生反应mX(g)
nY(g) ΔH=Q kJ·mol-1。反应达到平衡时,Y的物质的量浓度与温度、气体体积的关系如下表所示:
容器体积/L
温度/℃
c(Y)/mol·L-1
1 L
2 L
4 L
100℃
1.00
0.75
0.53
200℃
1.20
0.90
0.63
300℃
1.30
1.00
0.70
下列说法正确的是( )
A.m>n
B.Q<0
C.温度不变,压强增大,Y的质量分数减少
D.体积不变,温度升高,平衡向逆反应方向移动
难度: 困难查看答案及解析
-
反应N2O4(g)
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是 ( )

A.a、c两点的反应速率:a>c
B.a、c两点气体的颜色:a深,c浅
C.b、c两点的平衡常数:b<c
D.a、c两点气体的平均相对分子质量:a>c
难度: 中等查看答案及解析
-
在相同温度下,将H2和N2两种气体按不同比例通入相同的恒容密闭容器中,发生反应:3H2+N2
2NH3。
表示起始时H2和N2的物质的量之比,且起始时H2和N2的物质的量之和相等。下列图像正确的是( )

难度: 困难查看答案及解析
-
将一定量的氨基甲酸铵固体置于容积恒定的真空容器中,发生反应:H2NCOONH4(s)
2NH3(g)+CO2(g),在不同温度下,该反应达平衡状态时的部分数据如表所示。下列说法正确的是( )
温度
平衡浓度(mol·L-1)
c(NH3)
c(CO2)
T1
0.1
T2
0.1
A.若T2>T1,则该反应的ΔH<0
B.向容器中充入N2,H2NCOONH4质量增加
C.NH3体积分数不变时,说明该反应达到平衡
D.T1、T2时,转化的H2NCOONH4的物质的量Δn(T2)=2Δn(T1)
难度: 困难查看答案及解析
-
在t℃时,向一密闭容器(固定体积)中放入1mol A和1mol B,发生反应A(s) + B(g)
C(g) + 2D(g)达平衡时C的含量为m%,保持温度不变,若按下列配比的物质放入该容器中,达平衡时C的含量仍为m%的是( )
A.2molA和1molB B.2molD,1molA和1molB
C.2molC和4molD D.1molC和1molD
难度: 困难查看答案及解析
-
可逆反应①X(g)+2Y(g)
2Z(g)、②2M(g)
N(g)+P(g)分别在密闭容器的两个反应室中进行, 反应室之间有无摩擦、可滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

下列判断正确的是( )
A.在平衡(Ⅰ)和平衡(Ⅱ)中, M的体积分数相等
B.达平衡(Ⅰ)时, X的转化率为
C.达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14∶15
D.反应①的正反应是吸热反应
难度: 困难查看答案及解析
-
在相同温度下,体积均为1 L的四个密闭容器中,保持温度和容积不变,以四种不同的投料方式进行反应。平衡时有关数据如下(已知2SO2(g)+O2(g)
2SO3(g)ΔH=-196.6 kJ·mol-1)。
容器
甲
乙
丙
丁
起始投料量
2 mol SO2+1 mol O2
1 mol SO2+0.5 mol O2
2 mol SO3
2 mol SO2+2 mol O2
反应放出或吸收的热量(kJ)
a
b
c
d
平衡时c(SO3) (mol·L-1)
e
f
g
h
下列关系正确的是( )
A.a=c;e=g B.a>2b;e>2f C.a>d;e>h D.c+98.3e>196.6
难度: 困难查看答案及解析
