-
下列反应,一定是吸热反应的
A.释放能量 B.贮存能量 C.反应需要加热 D.非自发的化学反应
难度: 中等查看答案及解析
-
下列食品添加剂中,其使用目的与反应速率有关的是
A.调味剂 B.着色剂 C.增稠剂 D.抗氧化剂
难度: 中等查看答案及解析
-
反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1
下列有关反应速率的比较中正确的是
A.①>②>③>④ B.④<③=②<① C.④>③=②>① D.④>③>②>①
难度: 中等查看答案及解析
-
已知下列反应的平衡常数:①H2(g)+S(s)
H2S(g),K1;②S(s)+O2(g)
SO2(g),K2;则反应H2(g)+SO2(g)
O2(g)+H2S(g)的平衡常数是
A.K1+K2 B.K1-K2 C.K1×K2 D.
难度: 中等查看答案及解析
-
下列关于判断过程的方向的说法正确的是
A.所有自发进行的化学反应都是放热反应
B.同一物质的固、液、气三种状态的熵值相同
C.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行
D.由能量判据和熵判据组合而成的复合判据,将更适合于所有的过程
难度: 中等查看答案及解析
-
分析下列反应在任何温度下均能自发进行的是
A.2N2(g)+O2(g)===2N2O(g) ΔH=+163 kJ·mol-1
B.H2O2(l)===O2(g)+H2O(l) ΔH=-98 kJ·mol-1
C.HgO(s)===Hg(l)+O2(g) ΔH=+91 kJ·mol-1
D.Ag(s)+Cl2(g)===AgCl(s) ΔH=-127 kJ·mol-1
难度: 中等查看答案及解析
-
在密闭容器中发生反应:aA(g)
cC(g)+dD(g)反应达平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平
衡的1.8倍。下列叙述正确的是
A.A的转化率变大
B.平衡向逆反应方向移动
C.D的体积分数变大
D.a>c+d
难度: 中等查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3
mol·L-1、0.06 mol·L-1,则下列判断正确的是
A.c1∶c2=3∶1
B.X、Y的转化率不相等
C. c 1的取值范围为0
mol·L-1<c1<0.14 mol·L-1
D.平衡时,Y和Z的生成速率之比为3∶2
难度: 中等查看答案及解析
-
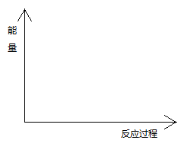
由反应物X分别转化为Y和Z的能量变化如图所示。下列说法正确的是

A.由
反应的ΔH=E5−E2
B.由
反应的ΔH>0
C.增大压强有利于提高Y的产率
D.降低温度有利于提高Z的产率
难度: 中等查看答案及解析
-
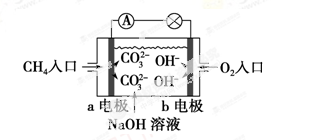
已知同一条件下,通过以下反应均可获取H2,下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l) = 2H2(g)+ O2(g) ΔH1= + 571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) = CO(g)+ H2(g)ΔH2= + 131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g) = CO(g)+3 H2(g)ΔH3= + 206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)= C(s)+2 H2(g)的ΔH = + 74.8kJ·mol–1
难度: 困难查看答案及解析
-
下列叙述正确的是
A.使用正催化剂能够提高反应物的转化率
B.原电池中发生的反应达到平衡时,该电池仍有电流产生
C.氢氧燃料电池工作时,H2在负极上失
去电子
D.探究温度对硫代硫酸钠与硫酸反应速率的影响时,若先将两种溶液混合并计时,再用水浴加热至设定温度,则测得的反应速率偏高
难度: 中等查看答案及解析
-
下列说法错误的是
A.原电池是化学电源的雏形
B.判断一种电池的优劣主要是看其负极的活泼性
C.依据原电池的原理设计出了化学电源
D.氧化还原反应所释放的化学能是化学电源的能量来源
难度: 中等查看答案及解析
-
下列说法错误的是
A.铅蓄电池是二次电池
B.碱性锌锰电池不是一次电池
C.一般化学电池的活性物质储存在电池内部,限制了电池容量
D.二次电池又叫蓄电池,它放电后可以再充电使
活性物质获得再生
难度: 简单查看答案及解析
-
随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A.回收其中的石墨电极
B.利用电池外壳的金属材料
C.防止电池中汞、镉和铅等重金属离子对土壤和水资源的污染
D.不使电池中渗泄的电解质腐蚀其他物品
难度: 简单查看答案及解析
-
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由大到小的顺序是
A.①③②④ B.①③④② C.③④②① D.③①②④
难度: 中等查看答案及解析
-
图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示

A.铜棒的质量
B.c(H+)
C.c(Zn2+)
D.c(SO42-)
难度: 中等查看答案及解析
-
某电池以K2Fe
O4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是
A.Zn为电池的负极
B.正极反应式为2FeO42-+
=Fe2O3+5H2O
C.该电池放电过程中电解质溶液浓度不变
D.电池工作时
向正极迁移
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2 倍,X、Y的核电荷数之比为3:4。W−的最外层为8电子结构。金属单质Z在空气中燃烧生成的化合物可与水发生氧化还原反应。下列说法正确的是
A. 化合物Z2Y和ZWY3都只存在离子键
B. 原子半径大小:X<Y,离子半径:Z>W
C. Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
D. X与Y能形成多种化合物,一般条件下都能与Z的最高价氧化物的水化物发生反应
难度: 困难查看答案及解析
-
已知W、X、Y、Z为短周期元素,原子序数依次增大。W、Z同主族,X、Y、Z同周期,其中只有X为金属元素。下列说法一定正确的是
A. 原子半径:X>Y>Z>W
B. W的含氧酸的酸性比Z的含氧酸的酸性强
C. W的气态氢化物的稳定性小于Y的气态氢化物的稳定性
D. 若W与X原子序数差为5,则形成化合物的化学式为X3W2
难度: 中等查看答案及解析
-
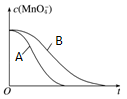
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是
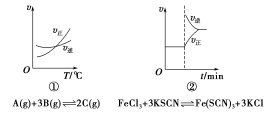
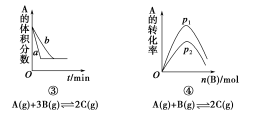
A.①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
难度: 困难查看答案及解析
-
一种基于酸性燃料电池原理设计的酒精检测仪,负极上的反应为CH3CH2OH-4e-+H2O=CH
3COOH+4H+。下列有关说法正确的是
A.检测时,电解质溶液中的H+向负极移动
B.若有0.4
mol电子转移,则在标准状况下消耗4.48 L氧气
C.正极上发生的反应为O2+4e-+2H2O===4OH-
D.电池反应的化学方程式为CH3CH2OH+O2===CH3COOH+H2O
难度: 中等查看答案及解析
-
金属(M)–空气电池(如图)具有原料易得、能量密度高等优点,有望成为新能源汽车和移动设备的电源。该类电池放电的总反应方程式为:4M+nO2+2n
H2O=4M(OH) n。已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能。下列说法正确的是
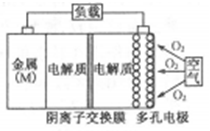
A.比较Mg、Al、Zn三种金属–空气电池,Mg–空气电池的理论比能量最高
B.M–空气电池放电过程的正极反应式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
C.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
D.在Mg–空气电池中,为防止负极区沉积Mg(OH)2,宜采用酸性电解质及阳离子交换膜
难度: 困难查看答案及解析
-
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是
A.容器内气体压强保持不变
B.吸收y mol H2只需1 mol MHx
C.若升温,该反应的平衡常数增大
D.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
难度: 中等查看答案及解析
-
已知图一表示的是可逆反应CO(g)+H2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是

A.图一t2时改变的条件可能是升高了温度或使用了催化剂
B.若图一t2时改变的条件是增大压强,则反应的ΔH增大
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大
难度: 困难查看答案及解析
-
一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)
CO(g)+3H2(g)。设起始
=Z,在恒压下,平衡时
(CH4)的体积分数与Z和T(温度)的关系如图所示。下列说法正确的是

A.该反应的焓变ΔH<0
B.图中Z的大小为b>3>a
C.图中X点对应的平衡混合物中
=3
D.温度不变时,图中X
点对应的平衡在加压后
(CH4)减小
难度: 困难查看答案及解析