-
化学来源于生活,也服务于生活,下列有关生活中的化学叙述正确的是
A.14C可用于文物年代的鉴定,14C与12C互为同素异形体
B.高空臭氧层吸收太阳紫外线,保护地球生物;低空过量臭氧是污染气体,对人体有害
C.光导纤维中所用材料为晶体硅
D.NOx、SO2、CO2、PM2.5颗粒都会导致酸雨
难度: 中等查看答案及解析
-
下列实验操作正确的是
A.中和滴定实验时,用待测液润洗锥形瓶
B.配制一定物质的量浓度溶液时,在溶解、移液、洗涤、定容时均要用到玻璃棒
C.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
D.NaCl溶液蒸发结晶时,蒸发皿中有晶体析出并剩余少量液体即停止加热
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是
A.常温常压下,14 g C2H4、C3H6的混合气体中含有碳原子的数目为NA
B.常温下,pH=12的Na2CO3溶液中含有的OH-离子数为0.01NA
C.标准状况下,0.56 L丙烷中含有共价键的数目为0.2 NA
D.含0.2mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为0.1NA
难度: 中等查看答案及解析
-
已知甲、乙、丙、X是四种中学化学中常见的物质,其转化关系如图所示。则甲和X 不可能是
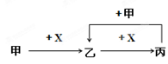
A.甲为C,X为O2
B.甲为NaOH溶液,X为SO2
C.甲为Fe,X为Cl2
D.甲为AlCl3,X为NaOH溶液
难度: 中等查看答案及解析
-
CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色。向反应后溶液中通入过量SO2,溶液变成无色。下列说法不正确的是
A.滴加KI溶液时,KI被氧化,CuI是还原产物
B.通入SO2后,溶液变无色,体现SO2的还原性
C.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
D.整个过程发生了复分解反应和氧化还原反应
难度: 中等查看答案及解析
-
用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
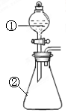
选项
①中物质
②中物质
预测②中的现象
A.
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B.
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C.
新制氯水
淀粉碘化钾溶液
溶液变蓝色
D.
浓盐酸
二氧化锰
产生黄绿色气体
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=14的溶液中:K+、Ca2+、HCO3-、SO42-
B.常温下,
=10﹣10 的溶液中:Na+、NH4+、SO42-、NO3-
C.c(ClO﹣)=1.0mol·L﹣1的溶液中:Na+、SO32-、S2-、SO42-
D.0.1 mol·L﹣1的NaAlO2溶液中:NH4+、Fe3+、Cl﹣、I﹣
难度: 困难查看答案及解析
-
下列表示对应反应的离子方程式正确的是
A.向稀 HNO3 中滴加 Na2SO3 溶液:SO32-+2H+=== SO2↑+H2O
B.双氧水中加入稀硫酸和KI溶液: H2O2+ 2I-+2H+=I2+ 2H2O
C.向 Al2(SO4)3 溶液中加入过量 NH3•H2O:Al3++4NH3•H2O === AlO2-+ 4NH4+ + 2H2O
D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
难度: 中等查看答案及解析
-
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是

A.锌电极上发生还原反应
B.电池工作一段时间后,甲池的c(SO42﹣)减小
C.电池工作一段时间后,乙池溶液的总质量增加
D.阴阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
难度: 中等查看答案及解析
-
下列关于普伐他汀的水解产物(结构简式如下图)的说法正确的是

A.含有两种官能团
B.能发生加成、酯化、氧化反应
C.1mol该物质与足量Na反应,产生2.5gH2
D.能使溴水和酸性高锰酸钾溶液褪色,褪色原理相同
难度: 中等查看答案及解析
-
下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法不正确的是
A.X、W、Z元素的气态氢化物的热稳定性依次递减
B.液态WX3气化需克服分子间作用力
C.根据元素周期律,可以推测T元素的单质具有半导体特性
D.Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
难度: 中等查看答案及解析
-
在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是
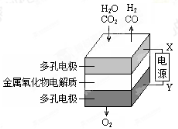
A.X是电源的负极
B.阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C.阴、阳两极生成的气体的物质的量之比是1︰1
D.总反应可表示为:H2O+CO2
H2+CO+O2
难度: 中等查看答案及解析
-
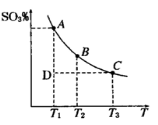
N2O5是一种新型硝化剂,在一定温度下可发生以下反应:2N2O5(g)
4NO2(g)+O2(g) ΔH>0。一定温度时,向密闭容器中通入N2O5,部分实验数据见下表:
时间/s
0
500
1000
1500
c(N2O5)/mol/L
0.50
0.35
0.25
0.25
下列说法中错误的是
A.500 s时O2的浓度为0.075 mol/L
B.平衡后,升高温度,正反应速率先增大后减小
C.平衡后,要使平衡常数增大,改变的条件是升高温度
D.1000 s时将容器的体积缩小一半,重新达到平衡时0.25 mol/L<c(N2O5)<0.50 mol/L
难度: 中等查看答案及解析
-
室温下向10mL0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA溶液pH的变化曲线如图所示。下列说法正确的是

A.a点所示溶液中c(Na+)>c(A—)>c(H+)>c(HA)
B.a、b两点所示溶液中水的电离程度相同
C.b点所示溶液中c(A—)> c(HA)
D.pH=7时,c(Na+)= c(A—)+ c(HA)
难度: 中等查看答案及解析
-
铁、铜混合粉末 18.0 g 加入到 100 mL 5.0 mol/LFeCl3 溶液中,剩余固体质量为 3.2 g。下列说法 正确的是
A.剩余固体是铁、铜混合物
B.原固体混合物中铜的质量是 9.6 g
C.反应后溶液中 n(Fe3+)=0.10 mol
D.反应后溶液中 n(Fe2+)+ n(Cu2+)=0.5 mol
难度: 中等查看答案及解析