-
化学与生活、生产密切相关。下列说法正确的是( )
A. 硫酸铁净水的原理和漂白粉消毒的原理相同
B. 汽车尾气中的氮氧化物是汽油不完全燃烧造成的
C. 研制高性能的耐磨轮胎,可减少PM2.5等细颗粒物的产生
D. 应用高纯度单质硅制成光导纤维,可提高信息传输速度
难度: 中等查看答案及解析
-
某有机物M的结构简式如图所示,下列说法错误的是( )
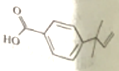
A. M的分子式为C12H14O2
B. M分子中的所有碳原子都可能处在同一平面上
C. 在一定条件下,M能发生加成、加聚、取代、氧化等反应
D. 在催化剂的作用下,1 molM最多能与4molH2加成
难度: 中等查看答案及解析
-
下列由实验得出的结论正确的是( )
实验
结论
A
将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变红色
Fe(NO3)2已变质
B
向AgNO3溶液中先滴加少量NaCl溶液,然后再滴加Na2S溶液,先生成白色沉淀,后生成黑色沉淀
溶解度:AgCl>Ag2S
C
实验室用盐酸和石灰石反应制取二氧化碳气体
非金属性:C<Cl
D
用相同物质的量浓度的HCOOH溶液和盐酸分别做导电性实验,HCOOH溶液对应的灯泡较暗
HCOOH 为弱电解质
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 16 gO2和O3混合气体中的质子数为8NA
B. 常温下,1L pH=1的H2SO4溶液中的H+数为0.2NA
C. 由0.1molCH3COONa和少量醋酸形成的中性溶液中,CH3COO-数目小于0.1NA
D. 标准状况下,2.24LCHCl3中含有的共价键数目为0.4NA
难度: 中等查看答案及解析
-
燃料电池型呼气酒精测试仪具有稳定性好,精度高,抗干扰性好等优点,是专门为警察设计的一款执法的检测工具,如图所示是一种酸性燃料电池酒精检测仪的示意图。下列说法错误的是( )
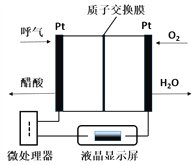
A. 该电池的负极反应式为:CH3CH2OH-4e-+H2O=CH3COOH+4H+
B. 当电路中有0.4mol电子转移时,消耗3.2gO2
C. 电池工作时H+从右向左通过质子交换膜
D. 微处理器通过检测电流大小可计算出被测气体中酒精的含量
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是次外层电子数的3倍,Y元素的化合价没有正价,Z元素是短周期中还原性最强的元素,W元素的最高价氧化物的对应水化物是短周期中酸性最强的无机含氧酸。下列说法正确的是( )
A. X、W的简单阴离子的电子层结构相同 B. 化合物Z2X2、WX2均具有强氧化性
C. 简单氢化物的热稳定性:Y<W D. 原子半径:X<Y<Z
难度: 中等查看答案及解析
-
25℃时,分别取浓度均为0.1mol·L-1的醋酸溶液和氨水溶液各20mL于两个锥形瓶中,分别用0.1mol·L-1NaOH溶液、0.1mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如右图所示。下列说法正确的是( )
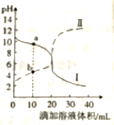
A. 25℃时,0.1mol·L-1的醋酸溶液中CH3COOH约有10%电离
B. 绘制曲线Ⅱ的实验中通过控制滴定管玻璃活塞控制滴定速度
C. 曲线Ⅰ上a点溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
D. 曲线Ⅱ上b点溶液中:c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
难度: 困难查看答案及解析
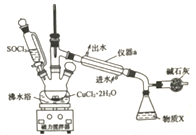
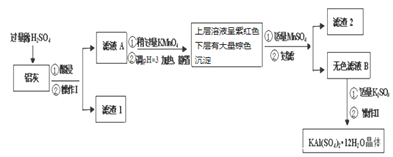
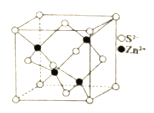
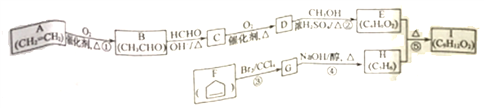
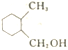 的合成路线:_________________(其他试剂任选)。
的合成路线:_________________(其他试剂任选)。