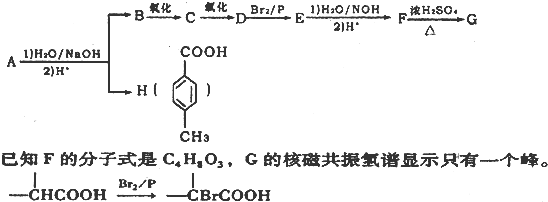
-
2011年为国际化学年.主题为“化学一我们的生活,我们的未来”.下列说法正确的是( )
A.制作航天服的聚酯纤维和用于光缆通信的晶体硅都是新型无机非金属材料
B.煤经过干馏加工可变为汽油、柴油等能源
C.石油化工生产中广泛使用过渡元素作催化剂,并加入少量稀土元素改善催化剂的性能
D.福尔马林(甲醛水溶液)可用于浸泡生肉及海产品以防腐保鲜难度: 中等查看答案及解析
-
下列说法错误的是( )
A.碱性锌锰干电池的负极反应式为:Zn+2OH--2e-=ZnO+H2O
B.化工厂中常采用阴极电保护法防止盛装酸性溶液的容器发生腐蚀
C.在电镀槽中,镀件做阴极,阳极可以选用惰性材料或者镀层金属
D.用惰性电极电解某硫酸铜溶液一段时间后.要恢复溶液的成分和浓度,可向溶液中加入一定量的氧化铜或氢氧化铜难度: 中等查看答案及解析
-
下列说法正确的是( )
A.葡萄糖能氧化氢氧化铜生成砖红色的氧化亚铜(Cu2O)
B.甲烷、苯、乙醇和乙酸在一定条件下都能发生取代反应
C.羊毛、蚕丝、棉花和麻等天然高分子材料的主要成分都是蛋白质
D.乙酸、甲酸乙酯和羟基乙醛互为同分异构体
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.金属铜放置在潮湿的空气中会被锈蚀,生成绿色的铜锈--碱式碳酸铜
B.金属氧化物一定是碱性氧化物
C.青铜(铜锡合金)是一种复合材料
D.金属钠可以保存在无水乙醇中难度: 中等查看答案及解析
-
下列根据元素周期表和元素周期律得出的推断,正确的是( )
A.金属元素原子最外层电子数越少.该金属失电子能力越强
B.若存在简单阴离子R2-,则R一定位于ⅥA族
C.P和As都是VA族元素,则PH3的还原性比AsH3的还原性强
D.铅位于周期表中金属和非金属的交界处,可作半导体材料难度: 中等查看答案及解析
-
常温下,将0.1mol.L-1.盐酸逐滴加入到20mL0.1mol•L-1氨水中,测得溶液的pH随加入盐酸的体积变化如图所示.下列说法正确的是( )
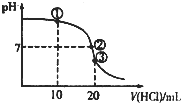
A.①溶液中c(Cl-)>c(OH-)>c(H+)
B.②溶液中:c(NH)=c(Cl-)=c(OH-)=c(H+)
C.③溶液中:c(Cl-)+c(H+)=+c(OH-)
D.滴定过程中可能出现:cc(Cl-)>c(H+)
难度: 中等查看答案及解析
-
已知298K时下列物质的溶度积(单位略)
下列说法正确的是( )CH3COOAg AgCl AgCrO4 AgS Ksp 2.3×10-3 1.77×10-10 1.12×10-12 6.7×10-15
A.等体积浓度均为0.02mol•L-1的CH3COONa和AgN03溶液混合能产生沉淀
B.离浓度均为0.01mol•L-1的CrO42-和Cl-混合溶液中慢慢滴入AgN03溶液时,CrO42-先沉淀
C.在CH3COOAg悬浊液中加人盐酸发生反应的离子方程式:CH3COOAg+H++C1-=CH3COOH+AgCl
D.298K时.上述四种饱和溶液的物质的量浓度:c(CH3COOAg)>c(AgCI)>c(Ag2CrO4)>c(Ag2S)难度: 中等查看答案及解析