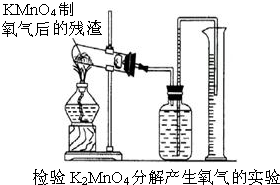
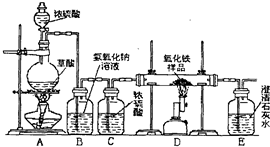
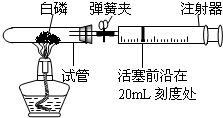
-
著名科学家居里夫人首先发现某些原子具有放射性,即原子能自动地放射出一些固定的粒子.一种元素的原子经过放射变成了另一种元素的原子,据此推断放射出的粒子一定是( )
A.电子
B.中子
C.质子
D.原子核难度: 中等查看答案及解析
-
化学上用符号“ZAX”表示原子的组成,其中X代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和.已知abXn+和cdYm-的电子层排布完全相同,则下列关系正确的是( )
A.b-a=d-c
B.a+n=c-m
C.a-n=c+m
D.b-n=d+m难度: 中等查看答案及解析
-
与Na+具有相同质子数和电子数的微粒是( )
A.F-
B.NH4+
C.OH-
D.H2O难度: 中等查看答案及解析
-
下列观点中正确的是( )
A.通过化学变化一定能改变物质的性质
B.改变物质的性质一定要通过化学变化
C.在化学变化中原子里的电子数不会改变
D.任何变化中原子核都不会发生改变难度: 中等查看答案及解析
-
今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+,NH4+,Ba2+,Cl-,CO32-,SO42-.现取两份200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体0.68 g;②第二份加足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤、干燥后,沉淀质量为2.33 g.根据上述实验,以下推测正确的是( )
A.一定不存在Ba2+,NH4+可能存在
B.CO32-一定存在
C.Na+一定不存在
D.一定不存在Cl-难度: 中等查看答案及解析
-
不久前,日本某一材料研究所的科学家发明了一种“碳纳米管温度计”,这种温度计被认定是目前世界上最小的温度计.研究人员在长约10-6m,直径为10-7m的碳纳米管中充入液态的金属镓.当温度升高时,管中镓就会膨胀,通过电子显微镜就能读取温度值.这种温度计测量的范围可从30℃到490℃,并且精确度较高,可用于检查电子线路是否异常、测量毛细血管的温度等许多方面.根据以上信息判断下列推测中正确的是( )
A.碳纳米管的体积在10℃至500℃之间随温度变化很小,可忽略不计
B.金属镓的熔点、沸点都很低
C.在30℃到490℃之间金属镓的体积与温度变化呈正比
D.金属镓的体积在30℃到490℃之间随温度变化很小,可忽略不计难度: 中等查看答案及解析
-
如图所示装置,有洗气、储气等用途.在医院给病人输氧气时,也利用了类似的装置,并在装置中盛放适量蒸馏水.以下说法不正确的是( )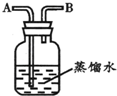
A.导管B连接供给氧气的钢瓶
B.导管B连接病人吸氧气的塑胶管
C.该装置可用来观察输出氧气的速度
D.该装置可用来调节输出氧气的速度难度: 中等查看答案及解析
-
人类的一切社会活动都有其自身的原理,下列活动的原理叙述错误的是( )
A.膜法淡化海水--用过滤法除去混合物中颗粒较大的杂质
B.海水晒盐--用蒸发结晶的方法从溶液中得到溶质晶体
C.核能发电--将化学能转化为电能
D.给农作物灌溉施肥--提供化学变化所需的反应物难度: 中等查看答案及解析
-
二氧化硫气体是造成酸雨的主要气体,其水溶液叫亚硫酸(H2SO3).硫化氢(H2S)是一种具有臭鸡蛋气味的剧毒气体,其水溶液叫氢硫酸.已知相同的条件下,氢硫酸的酸性弱于亚硫酸.在室温下向饱和的亚硫酸溶液中通入过量的硫化氢气体,反应的化学方程式为:2H2S+H2SO3=3S↓+3H2O.则下图中溶液的pH随通入硫化氢体积的变化曲线示意图正确的是( )
A.
B.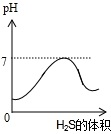
C.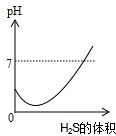
D.
难度: 中等查看答案及解析
-
CO和O2的混合气体48g,在一定条件下充分反应后,生成44g CO2,则原混合气体中CO和O2的质量比可能是( )
A.2:1
B.7:4
C.7:5
D.7:8难度: 中等查看答案及解析
-
下列行为,可能对人类生存环境会造成危害的是( )
A.使用塑料大棚大量种植反季节蔬菜
B.大力推广使用太阳能热水器
C.向洗涤产品中添加磷酸钠等增强其去污能力
D.大力推广种植高产杂交水稻难度: 中等查看答案及解析
-
科学家最近在-100℃的低温下合成一种化合物X,此分子的模型如下图,其中每个
代表一个碳原子,每个○代表一个氢原子.下列说法中不正确的是( )

A.该分子的分子式为C5H4
B.该分子中碳元素的质量分数是93.75%
C.该分子中的氢原子与碳原子的个数比是4:5
D.等质量的该物质与甲烷相比,燃烧时消耗的氧气更多难度: 中等查看答案及解析
-
中国科学家以二氧化碳和金属钠为原料,在一定条件下制得了金刚石,化学方程式为:3CO2+4Na
xR+C(金刚石),则x;R为( )
A.1;Na2CO3
B.2;Na2CO3
C.3;Na2CO3
D.4;Na2O2难度: 中等查看答案及解析
-
烧杯中盛满一定浓度的醋酸溶液(溶液密度约为1 g/cm3),全部倾倒后烧杯内仍残留0.5 mL溶液,用每次20 mL蒸馏水冲洗了2次,此时烧杯中残留的醋酸溶液的浓度约为原先的( )
A.
B.
C.
D.无法确定难度: 中等查看答案及解析
-
某学生测得海水中含Cl-的质量分数为2.19%,如果全部以NaCl计算,则海水中所含NaCl的质量分数是( )
A.2.82%
B.5.85%
C.3.60%
D.4.91%难度: 中等查看答案及解析