-
读下列药品标签,有关分析不正确的是( )
选项
A
B
C
D
物品
标签

药品:×××

分析
该试剂应装在橡胶塞的细口瓶中
该药品不能与皮肤直接接触
该物质受热易分解
该物质浓度为18.4 mol/L
难度: 简单查看答案及解析
读下列药品标签,有关分析不正确的是( )
| 选项 | A | B | C | D |
| 物品 |
|
|
|
|
| 分析 | 该试剂应装在橡胶塞的细口瓶中 | 该药品不能与皮肤直接接触 | 该物质受热易分解 | 该物质浓度为18.4 mol/L |
难度: 简单查看答案及解析
某气体的摩尔质量为M g/mol,NA表示阿伏加德罗常数的值,在一定温度和压强下,体积为VL的该气体含有分子数X,则 MX/(VNA) 表示的是( )
A.该气体的密度(以g/L为单位)
B.VL该气体的质量(以g为单位)
C.1mol该气体的体积(以L为单位)
D.1L该气体中所含的分子数
难度: 简单查看答案及解析
设NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A.NA个氮气分子与3NA个氢气分子恰好生成2NA个氨气分子
B.在1L0.1mol/L的AlCl3溶液中含有0.1NA个AI3+
C.常温常压下,22.4 L氯气与足量镁粉充分反应,转移的电子数为2NA
D.5.6g的铁与足量的稀硝酸反应转移的电子数是0.3NA
难度: 简单查看答案及解析
逻辑推理是化学学习中常用的一种思维方式,以下推理中正确的是( )
A.化合物都是由不同元素组成的,故不同元素组成的物质一定是化合物
B.在金属活动性顺序表中排在氢元素前的金属能与酸反应放出氢气,金属镁排在氢的前面,所以金属镁一定与硝酸反应放出氢气
C.有新物质生成的变化属于化学变化,所以化学变化一定有新物质生成
D.单质都是由一种元素组成的,所以由一种元素组成的物质一定是单质
难度: 简单查看答案及解析
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的( )
| 操作 | 现象 | 结论 | |
| ① | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| ② | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| ③ | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
| ④ | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管 | 试纸不变蓝 | 原溶液中无NH4+ |
难度: 简单查看答案及解析
下列离子方程式的书写及评价均合理的是( )
| 选项 | 离子方程式 | 评价 |
| A | 将2molCl2通入到含1molFeI2的溶液中: 2Fe2++2I—+2Cl2 = 2Fe3++4Cl-+I2, | 正确;Cl2过量,可将Fe2+ 、I- 均氧化 |
| B | Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++ HCO3—+ OH—= MgCO3↓+ H2O | 正确;酸式盐与碱反应生成正盐和水 |
| C | 过量SO2通入到NaClO溶液中: SO2 + H2O + ClO- = HClO+HSO3- | 正确; 说明酸性: H2SO3强于HClO |
| D | 1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2- + 5H+ = Al3+ + Al(OH)3↓+ H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
难度: 简单查看答案及解析
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol·L-1 NaOH溶液:K+、Na+、SO42-、CO32-
B.0.1 mol·L-1 Na2CO3溶液:K+、Ba2+、NO3-、Cl-
C.0.1 mol·L-1 FeCl3溶液:K+、NH4+、I-、SCN-
D.=1×1014的溶液:Ca2+、Na+、ClO-、NO3-
难度: 简单查看答案及解析
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况回答下列问题:
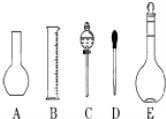
(1)如图所示的仪器中配制溶液肯定不需要的是__________(填序号),仪器C的名称是__________,本实验所需玻璃仪器E规格为__________mL.
(2)下列操作中,容量瓶所不具备的功能有__________(填序号).
A.配制一定体积准确浓度的标准溶液 B.长期贮存溶液
C.用来加热溶解固体溶质 D.量取一定体积的液体
(3)在配制NaOH溶液实验中,其他操作均正确.若定容时仰视刻度线,则所配制溶液浓度__________0.1mol/L(填“大于”“等于”或“小于”,下同).若NaOH溶液未冷却即转移至容量瓶定容,则所配制溶液浓度__________0.1mol/L.
(4)根据计算得知,所需质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为______mL(计算结果保留一位小数).如果实验室有10mL、25mL、50mL量筒,应选用__________mL规格的量筒最好.
难度: 简单查看答案及解析
(1)已知Fe(OH)3能与次氯酸盐发生如下反应(未配平):
Fe(OH)3 + ClO- + OH- → FeO4n- + Cl- + H2O
①已知有10.7g Fe(OH)3参加反应,共转移了0.3NA个电子,则n= ,FeO4n-中铁元素的化合价为 .
②根据所学的知识,推测FeO4- 能和下列 (填序号)物质反应.
A.KMnO4 B.SO2 C.H2S D.O2
(2)一定条件下,向含硝酸的废水中加入CH3OH,将HNO3还原成N2.若该反应消耗32g CH3OH,转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是____________
难度: 简单查看答案及解析
A、B、C、D、E五种可溶性化合物,分别由阳离子Fe3+、Ba2+、Al3+、Na+、Ag+和阴离子NO3— 、OH-、SO42—、Cl-、CO32— 中的各一组成(离子不重复)。现做如下实验:
①A和E的溶液显碱性,0.1 mol·L-1 A溶液的pH小于13;
②在B的溶液中逐滴加入氨水有白色沉淀生成,继续加氨水至过量,沉淀消失;
③在C的溶液中加入铁粉,溶液的质量增加;
④在D的溶液中加入过量的Ba(OH)2溶液,没有沉淀。
根据以上事实推断各物质的化学式:
A____________;B____________;C____________;D____________;E____________。
写出③中涉及的离子方程式
写出④中涉及的离子方程式
难度: 简单查看答案及解析