-
下列反应中,反应物的用量或浓度改变时,不会改变生成物的是
A. 铜与硝酸反应 B. 明矾溶液与烧碱溶液反应
C. 碳酸钠溶液和盐酸反应 D. 硫在氧气中燃烧
难度: 困难查看答案及解析
-
下列有关实验事实的解释正确的是
A. 高锰酸钾溶液中通入SO2后,颜色褪去,SO2表现了漂白性
B. 铁粉投入同浓度的Cu(NO3)2和AgNO3混合液先析出Ag,说明Ag+氧化性比Cu2+强
C. 常温下,将铝片放入浓硫酸中无明显现象,说明铝和冷的浓硫酸完全不反应
D. 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有吸水性
难度: 困难查看答案及解析
-
某固体可能含有NH4+、Cu2+、Na+、Cl-、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验(不考虑盐类的水解及水的电离);
(1)一份固体溶于水得无色透明溶液,加入足量BaCl2溶液,得沉淀6.27g,在沉淀中加入过量稀盐酸,仍有2.33g沉淀。
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体0.672L(标准状况)。
下列说法正确的是
A. 该固体中一定含有NH4+、CO32-、SO42-、Na+
B. 该固体中一定没有Cu2+、Cl-、Na+
C. 该固体中只含有NH4+、CO32-、SO42-、Cl-
D. 根据以上实验,无法确定该固体中有Na+
难度: 中等查看答案及解析
-
可用浓硫酸干燥的气体是
A. SO2 B. H2S C. HBr D. NH3
难度: 简单查看答案及解析
-
某元素X的气态氢化物化学式为XH3,其最高价氧化物对应水化物化学式不可能是
A. HXO3 B. H2XO4 C. H3XO4 D. H4X2O7
难度: 中等查看答案及解析
-
下列溶液肯定呈酸性的是
A. 含H+的溶液 B. 加酚酞显无色的溶液
C. pH<7的溶液 D. c(OH-)<c(H+)的溶液
难度: 中等查看答案及解析
-
化学式为N2H6SO4的某晶体,其晶体类型与硫酸铵相同,则N2H6SO4晶体中不存在
A.离子键 B.共价键 C.分子间作用力 D.阳离子
难度: 中等查看答案及解析
-
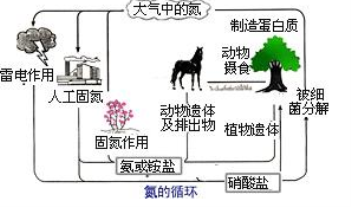
关于氮肥的说法正确的是( )
A. 硫铵与石灰混用肥效增强 B. 植物吸收氮肥属于氮的固定
C. 使用碳铵应深施盖土 D. 尿素属于铵态氮肥
难度: 中等查看答案及解析
-
下列混合物用加热的方法可分离的是( )
A. 氯化铵和氢氧化钙 B. 碘和氯化铵
C. 氯化铵和氯化钠 D. 氯化铵和碳酸氢钠
难度: 中等查看答案及解析
-
为了检验某固体物质中是否含有NH4+,下列试纸和试剂一定用不到的是 ( )
A. NaOH溶液 B. 稀硫酸 C. 浓盐酸 D. 红色石蕊试纸
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 经分析某物质只含有一种元素,则该物质一定是单质
B. 质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子
C. 碱性氧化物一定是金属氧化物
D. NO2不是酸性氧化物,也不是亚硝酸酸酐
难度: 中等查看答案及解析
-
目前科学家们已经合成许多硫-氮化合物,其中一种结构如图所示。关于该物质说法正确的是

A. 该物质的分子式为SN
B. 该物质熔、沸点较低
C. 该物质分子中所有原子的最外层均达到稳定结构
D. 该物质与化合物S2N2互为同素异形体
难度: 中等查看答案及解析
-
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
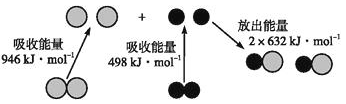
下列说法中正确的是( )
A. 1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C. 1 mol N2(g)和1 mol O2(g)具有的总键量大于2 mol NO(g)具有的总键量
D. 通常情况下,N2(g)和O2(g)混合能直接生成NO
难度: 中等查看答案及解析
-
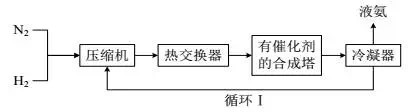
已知反应:3Cl2+NH3→6NH4Cl+N2,下列分析正确的是(设阿伏伽德罗常数为NA)
A. 若3molCl2反应,得到氧化产物6mol
B. 若常温下生成22.4LN2,转移电子数6NA
C. 若转移6mol电子,被氧化的NH3是8mol
D. 若生成1 molNH4Cl转移电子n个,则NA=n
难度: 困难查看答案及解析
-
25℃时,将某强酸和某强碱溶液按10∶1的体积比混合溶液恰好呈中性,则混合前此强酸与强碱溶液的pH之和是
A、12 B、13 C、14 D、15
难度: 简单查看答案及解析
-
四支试管分别充满O2、NO2、Cl2、NH3四种气体,把它们分别倒立于盛有下列各种液体的水槽中,发生的现象如下图所示,其中充满NO2的试管是( )
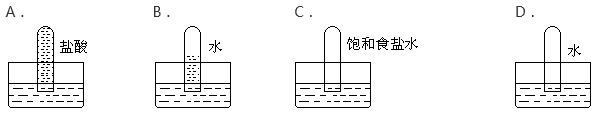
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
气体X和气体Y通入液体Z的洗气瓶中(如图),一定没有沉淀生成的是( )
X
Y
Z

A
NO2
SO2
BaCl2
B
NH3
Cl2
Fe2(SO4)3
C
NH3
CO2
NaCl
D
CO2
SO2
CaCl2
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
为证明稀硝酸与铜反应产物中气体为NO,设计如图实验(实验过程中活塞2为打开状态),下列说法中不正确的是
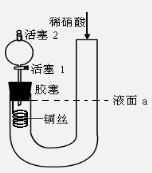
A.关闭活塞1,加入稀硝酸至液面a处
B.在装置左侧稍加热可以加快稀硝酸与铜的反应速率
C.通过关闭或开启活塞1可以控制反应的进行
D.反应开始后,胶塞下方有无色气体生成,还不能证明该气体为NO
难度: 困难查看答案及解析
-
在某100mL混合酸溶液中,HNO3和H2SO4的物质的量浓度分别为0.4mol•L-1和0.1mol•L-1,向该混合液中加入1.92g铜粉,加热充分反应后,设溶液的体积仍为100 mL,则所得溶液的Cu2+的物质的量浓度为( )
A. 0.15mol•L-1 B. 0.225mol•L-1 C. 0.3mol•L-1 D. 不能确定
难度: 困难查看答案及解析