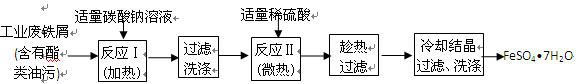
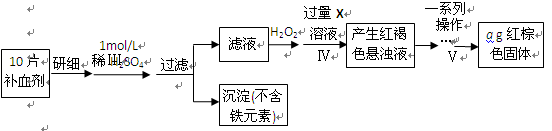
-
2011年是国际化学年,中国的宣传口号是“化学——我们的生活,我们的未来”。下列有关叙述错误的是
A.在家用燃煤中加入适量的生石灰能有效减少二氧化硫的排放量
B.大量排放SO2或CO2都会导致酸雨的形成
C.采用纳米二氧化钛光触媒技术,将汽车尾气中的NO和CO转化为无害气体
D.利用清洁能源如太阳能、潮汐能、风能来发电
难度: 中等查看答案及解析
-
下列说法正确的是
A.HCHO溶液、(NH4)2SO4溶液均能使蛋白质变性
B.煤的干馏是物理变化,煤的气化和液化是化学变化
C.纤维素、蛋白质、油脂在一定条件下都能发生水解反应
D.分子式为CH4O和C2H6O的物质一定互为同系物
难度: 中等查看答案及解析
-
已知0.1 mol/L的碳酸氢钠溶液的pH为8.4,则下列说法正确的是
A.加入少量NaOH固体,钠离子和碳酸根离子浓度均增大
B.将该溶液加水稀释,
的比值保持不变
C.c(Na+)+c(H+)=c(HCO3- )+c(CO32 -)+c(OH-)
D.c(Na+)=c(HCO3- )+2c(CO32 -)+c(H2CO3)
难度: 中等查看答案及解析
-
向明矾溶液中逐渐滴加Ba(OH)2溶液,符合要求的离子方程式为
A.加入过量的Ba(OH)2溶液时:2Al3++3SO42-+3Ba2++6OH—= 2Al(OH)3↓+3BaSO4↓
B.溶液恰好呈中性时:2Al3++3SO42-+3Ba2++6OH— = 2Al(OH)3↓+3BaSO4↓
C.SO42-离子恰好完全沉淀时:Al3++SO42-+Ba2++4OH— = AlO2-+BaSO4↓+2H2O
D.明矾与Ba(OH)2按物质的量比1∶1反应时:Al3++SO42-+Ba2++3OH—= Al(OH)3↓+BaSO4↓
难度: 中等查看答案及解析
-
新型纳米材料MFe2Ox (3<x<4)中M表示+2价的金属元素,在反应中化合价不发生变化。常温下,MFe2Ox能使工业废气中的SO2转化为S,流程如下:
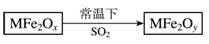
则下列判断正确的是
A.MFe2Ox是还原剂 B.SO2是该反应的催化剂
C.x>y D.SO2发生了置换反应
难度: 中等查看答案及解析
-
已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是

A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
难度: 中等查看答案及解析
-
有a克Na2CO3和NaHCO3混合物,下列实验方案中可测定其中Na2CO3质量分数的是
①将混合物与足量稀盐酸充分反应,逸出气体用碱石灰吸收,碱石灰增重b克
②将混合物充分加热,固体质量减少b克
③将混合物与足量BaCl2溶液充分反应,过滤、洗涤、烘干,得b克固体。
④将混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,碱石灰增重b克
A.①② B.②③ C.②④ D.③④
难度: 中等查看答案及解析