已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是

A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
高三化学选择题中等难度题
已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是

A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
高三化学选择题中等难度题

高三化学选择题中等难度题查看答案及解析
已知结构为正四面体型的离子A和直线型离子B反应,生成三角锥形分子C和V形分子D(A、B、C、D均为10电子微粒,组成它们的元素原子序数均小于10),下列说法正确的是

A.分子C与D不能发生化学反应
B.微粒A的空间结构与CH4相似,它们均为正四面体,所以A是非极性分子
C.固态D的熔沸点明显高于固态H2S的原因在于D分子中的共价键强于S-H键
D.在25℃时,A的盐酸盐溶液的pH小于7
高三化学选择题中等难度题查看答案及解析
高三化学选择题中等难度题查看答案及解析
氨气与氟气反应得到一种三角锥形分子M和一种铵盐N。下列有关说法错误的是( )
A.M既是氧化产物,又是还原产物
B.M是极性分子,其还原性比NH3强
C.N中阴、阳离子均为10电子微粒
D.N中既含有离子键,又含有共价键
高三化学单选题中等难度题查看答案及解析
用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是( )
A.NH4+为正四面体形 B.CS2为直线形
C.HCN为折线形(V形) D.PCl3为三角锥形
高三化学选择题中等难度题查看答案及解析
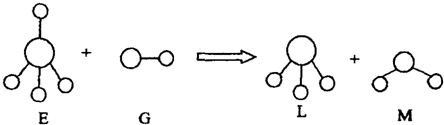
已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M (组成E、G、L、M分子的元素原子序数均小于10) 如下图,则下列判断错误的是
A.G是最活泼的非金属单质 B.M化学性质活泼
C.E能使紫色石蕊试液变蓝色 D.L是极性分子
高三化学选择题中等难度题查看答案及解析
原子个数相同、核外电子数相同的分子(离子)的空间构型相同。以下微粒为三角锥形的是
A.NH4+ B.H3O+ C.H2S D.CH4
高三化学选择题中等难度题查看答案及解析
高三化学选择题中等难度题查看答案及解析
下列对分子或离子的立体构型判断不正确的是 ( )。
A.NH和CH4都是正四面体形
B.CO2和CS2都是直线形
C.NCl3和BCl3都是三角锥形
D.H2O和H2S都是V形
高三化学选择题简单题查看答案及解析
下列对分子或离子的立体构型判断不正确的是 ( )。
A.NH4+和CH4都是正四面体形
B.CO2和CS2都是直线形
C.NCl3和BCl3都是三角锥形
D.H2O和H2S都是V形
高三化学选择题简单题查看答案及解析