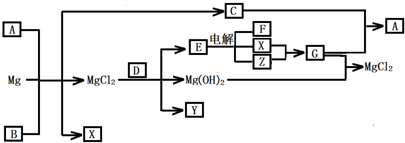
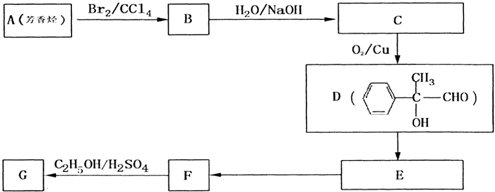
-
生活中的化学无处不在,根据所学的化学知识判断下列说法错误的是( )
A.去年以来,我国北方多省市遭遇严重干旱,气象部门密切监视天气变化,抓住有利天气时机组织开展人工增雨(雪)作业.干冰和碘化银都可用于人工增雨(雪)
B.新装修的房屋不宜立即入住,因为装修材料会释放出对人体有害的甲醛等气体
C.卫生部公告2011年5月1日起全面叫停面粉增白剂,由此可知:应当严格禁止在食品中使用任何食品添加剂
D.车用乙醇汽油的推广使用不仅可以减少环境污染,还可以缓解我国石油短缺的局面,将成为我国可持续发展的一项长期战略难度: 中等查看答案及解析
-
根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱.按照这个理论,下列微粒属于两性物质的是( )
①HS- ②③
④NH3 ⑤H2S ⑥CH3COOH ⑦OH- ⑧H2O ⑨
⑩
H2COOH.
A.①⑤
B.③⑥
C.①②⑨
D.①③⑧⑩难度: 中等查看答案及解析
-
2010年世博会上,俗称“紫蚕岛”的日本馆顶部采用了一种名为EFTE(乙烯一四氟乙烯共聚物)的淡紫色膜材料.它有最大程度的透光性,膨胀后的枕头状内部通过非晶体太阳能电池可以完成内部发电.根据所学的化学知识判断有关EFTE膜材料的说法错误的是( )
A.EFTE没有固定的熔沸点
B.EFTE是由乙烯和四氟乙烯两种单体经过加聚反应生成,而不是直接混合而成的
C.EFTE结构中含有碳碳双键,可以使溴的四氯化碳溶液褪色
D.EFTE具有高抗污,易清洗等优点难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
A.标准状况下,密度为ρg•L-1的某气体纯净物一个分子的质量为
B.17g甲基(-14CH3)所含电子数为7NA
C.1mol C6H14分子中共价键总数为20 NA
D.常温下,0.2molCl2溶于等体积水中,转移电子数为0.2 NA难度: 中等查看答案及解析
-
下表选项中对规定反应的离子方程式的评价合理的是( )
选项 反应 离子方程式 评价 A FeI2和Cl2以5:7的物质的量比反应 4Fe2++10I一+7Cl2=4Fe3++5I2+14Cl一 正确
B碳酸氢钠溶液与足量
的氢氧化钡溶液反应Ba2++20H一+2HC03=BaC03↓+C032-+2H2 正确 C 金属Na和CuS04溶
液反应Na+Cu2+=Na++Cu 错误.离子方程式不
符合电荷守恒原则
D过量二氧化碳通入次
氯酸钙溶液中反应2Cl0一+H20+C02=2HCl0+CO32- 错误.生成物碳酸钙
不应写成离子形式
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
T℃时,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
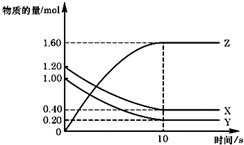
A.平衡时X、Y的转化率相同
B.达到平衡后,将容器体积扩大为4 L,平衡向逆反应方向移动
C.T℃时,若起始时X为0.71 mol,Y为1.00 mol,则平衡时Y的转化率为60%
D.T℃时,该反应的化学方程式为:X(g)+Y(g)⇌2Z(g),平衡常数K=40难度: 中等查看答案及解析
-
下列说法正确的是( )
A.镁与极稀硝酸反应生成硝酸铵的离子方程式为:4Mg+6H++NO3-=4Mg2++NH4++3H2O
B.25℃时,将20 mL 0.1mol•L-1H2SO4溶液和30 mL 0.15mol•L-1NaOH溶液混合,若混合后溶液体积不变,则混合溶液的pH为11
C.将10 mL 0.1 mol•L-1KAI(SO4)2溶液和10 mL0.2 mol•L-1Ba(OH)2溶液混合,得到的沉淀中Al(OH)3和BaSO4的物质的量之比为1:2
D.浓度均为0.1 mol•L-1的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)难度: 中等查看答案及解析