-
下列电离方程式正确的是 ( )
A. NaHS 溶于水: NaHS=Na+ + HS- HS- + H2O
H3O+ + S2-
B. (NH4)2SO4溶于水: (NH4)2SO4
2NH4+ + SO42-
C. 磷酸溶于水中: H3PO4
3H+ + PO43-
D. Al(OH)3的电离: Al(OH)3
Al3+ + 3OH-
难度: 简单查看答案及解析
-
在醋酸的下列性质中,可以证明它是弱电解质的是 ( )
A. 1mol/L的醋酸溶液中H+浓度约为10-3mol/L B. 醋酸能与水以任意比互溶
C. 10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应 D. 醋酸的导电性比强酸溶液弱
难度: 简单查看答案及解析
-
下列说法不正确的是 ( )
A. 催化剂能够改变化学反应路径 B. 升高温度提高了活化分子百分数
C. 增大反应物浓度提高了活化分子百分数 D. 增大压强能增大活化分子的浓度
难度: 简单查看答案及解析
-
在2 A(g)+B(g)
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. υ(A)=0.5mol/(L·s) B. υ(B)=0.3mol/(L· s) C. υ(C)=0.8mol/(L·s) D. υ(D)=1mol/(L·s)
难度: 中等查看答案及解析
-
密闭容器中A与B反应生成C,其反应速率分别用v (A)、v (B)、v (C)表示。已知v (A)、v (B)、v (C)之间有以下关系2 v (B) =" 3" v (A)、3 v (C) =" 2" v (B)。则此反应可表示为
A. 2A + 3B = 2C B. A + 3B = 2C C. 3A + B = 2C D. A + B = C
难度: 简单查看答案及解析
-
一定温度下,反应N2(g)+O2(g)
2NO(g) 在密闭容器中进行,下列措施不改变化学反应速率的是
A. 缩小体积使压强增大 B. 恒容,充入N2 C. 恒容,充入He D. 恒压,充入He
难度: 中等查看答案及解析
-
100℃时,将0.1 mol N2O4置于1 L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
2NO2(g)。下列结论不能说明上述反应该条件下已经达到反应限度的是
①N2O4的消耗速率与NO2的生成速率之比为1∶2;②NO2的生成速率与NO2消耗速率相等 ③烧瓶内气体的压强不再变化;④烧瓶内气体的质量不再变化;⑤NO2的物质的量浓度不再改变;⑥烧瓶内气体的颜色不再加深;⑦烧瓶内气体的平均相对分子质量不再变化;⑧烧瓶内气体的密度不再变化
A. ②③⑥⑦ B. ①④⑧ C. 只有①④ D. 只有⑦⑧
难度: 简单查看答案及解析
-
在体积可变的密闭容器中,反应mA(g)+nB(s)
pC(g)达到平衡后,压缩容器的体积,发现A的转化率随之降低。下列说法中,正确的是 ( )
A. (m+n)必定小于p B. (m+n)必定大于p
C. m必定小于p D. n必定大于p
难度: 简单查看答案及解析
-
如图所示,反应:X(g)+3Y(g)
2Z(g) △H>0,在不同温度、不同压强(P1>P2)下,达到平衡时,混合气体中Z的百分含量随温度变化的曲线应为 ( )
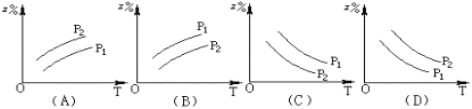
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
A. 等于p% B. 大于p% C. 小于p% D. 无法判断
难度: 困难查看答案及解析
-
下列说法中正确的是 ( )
A. 电离常数受溶液浓度的影响.
B. 电离常数可以表示弱电解质的相对强弱.
C. 电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大.
D. H2CO3的电离常数表达式为Ka=
难度: 中等查看答案及解析
-
下图表示可逆反应mA(g) +nB(s)
xC(g)在不同温度和压强下,反应物A的转化率变化情况。下列判断正确的是 ( )

A. m>x,正反应为放热反应
B. m+n<x,正反应为吸热反应
C. m<x,正反应为放热反应
D. m>x,正反应为吸热反应
难度: 中等查看答案及解析
-
密闭容器中,反应xA(g)+yB(g)
zC(g)达平衡时,A的浓度为0.5mol/L,若保持温度不变,将容器的容积扩大到原来的2倍,达新平衡时A的浓度降为0.3mol/L。下列判断正确的是
A. x+y<z B. 平衡向正反应方向移动
C. B的转化率降低 D. C的体积分数增大
难度: 中等查看答案及解析
-
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol·L-1
0.1
0.2
0
平衡浓度/mol·L-1
0.05
0.05
0.1
下列说法错误的是( )
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y
2Z,其平衡常数为1600
C. 增大X浓度使平衡向生成Z的方向移动,X体积分数减小
D. 改变温度可以改变此反应的平衡常数
难度: 中等查看答案及解析
-
下列说法中,能说明化学平衡一定向正反应方向移动的是( )
A. N2O4(g)
2NO2(g),改变某一条件后,气体颜色加深
B. H2(g)+I2(g)
2HI(g),单位时间内消耗H2和HI的物质的量之比大于1:2
C. N2(g)+3H2(g)
2NH3(g),改变某一条件后,NH3的体积分数增加
D. 2SO2(g) +O2(g)
2SO3(g),恒温恒压条件下,充入He
难度: 中等查看答案及解析
-
一定温度下,在4个容积均为1 L的恒容容器中分别进行反应(各容器中A都足量)A(s)+B(g)
C(g)+D(g) ΔH =+100 kJ·mol-1,某时刻测得部分数据如下表:
容器编号
n(B)/mol
n(C)/mol
n(D)/mol
反应时间/min
反应速率
Ⅰ
0.06
0.60
0.10
t1
v(正)=v(逆)
Ⅱ
0.12
1.20
0.20
t2
Ⅲ
0.32
1.0
0
0
Ⅳ
0.12
0.30
v(正)=v(逆)
下列说法正确的是
A.容器Ⅰ中平均反应速率v(B)=0.04/t1 mol·L-1·min-1
B.t2时容器Ⅱ中v(正)>v(逆)
C.容器Ⅲ中反应至平衡时吸热20 kJ
D.容器Ⅳ中c(D)= 0.4 mol·L-1
难度: 中等查看答案及解析
-
对于反应N2O4(g)
2NO2(g),在温度一定时,平衡体系中NO2的体积分数ψ(NO2)随压强的变化情况如图所示(实线上的任何一点为对应压强下的平衡点),下列说法正确的是( )
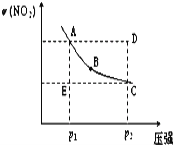
A. A、C两点的正反应速率的关系为v(A)<v(C)
B. A、B、C、D、E各状态中,v(正)<v(逆)的是状态E
C. 维持p1不变,E→A所需时间为x;维持p2不变,D→C所需时间为y,则x<y
D. 使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态,从理论上来讲,可选用的条件是从p1突然加压至p2,再由p2无限缓慢降压至p1
难度: 中等查看答案及解析
-
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)
PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见下表:下列说法正确的是( )
t/s
0
50
150
250
350
N(PCl3)/mol
0
0.16
0.19
0.20
0.20
A. 反应在前50s的平均速率为v(PCl3)=0.0032mol•L﹣1•s﹣1
B. 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L﹣1,则反应的△H<0
C. 相同温度下,起始时向容器中充入1.0mol PCl5、0.20mol PCl3和0.20mol Cl2,达到平衡前v(正)<v(逆)
D. 相同温度下,起始时向容器中充入2.0mol PCl3、2.0mol Cl2,达到平衡时,PCl3的转化率>80%
难度: 中等查看答案及解析
-
可逆反应①X(g)+2Y(g)
2Z(g)、②2M(g)
N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦力、可自由滑动的密封隔板。反应开始和达到平衡状态时有关物理量的变化如图所示:

下列判断正确的是( )
A. 反应①的正反应是吸热反应
B. 达平衡(I)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(I)时,X的转化率为5/11
D. 在平衡(I)和平衡(II)中,M在隔板右边气体中的体积分数不变
难度: 极难查看答案及解析