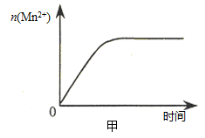
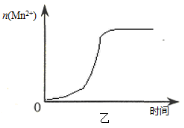
-
某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-。向该溶液中加入铝粉,只放出H2,则溶液中能大量存在的离子最多有
A.3种 B.4种 C.5种 D.6种
难度: 中等查看答案及解析
-
下列各组混合物,使用氢氧化钠溶液和盐酸两种试剂不能分离的是
A.氧化镁中混有氧化铝
B.氯化铝溶液中混有氯化铁
C.氧化铁中混有二氧化硅
D.氯化亚铁溶液中混有氯化铜
难度: 简单查看答案及解析
-
下列说法正确的是
A. 化学键的变化必然会引起能量变化,所以,能量变化也一定会引起化学变化
B. 所有化学变化的能量都可以通过原电池转化为电能
C. 所有化学变化一定遵循质量守恒和能量守恒
D. 化学变化一定会引起物质种类的变化,所以体系内物质种类变化一定发生了化学变化
难度: 中等查看答案及解析
-
钾和钠的性质相似,其本质原因是
A. 都是金属元素 B. 最外层电子数相同
C. 原子半径相差不大 D. 最高化合价相同
难度: 简单查看答案及解析
-
元素周期表是学习化学的重要工具。下图是元素周期表中的一格,以下对该图信息的解读中,不正确的是
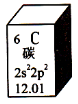
A.该元素的原子序数为6
B.该元素所有原子的质子数均为6
C.该元素的相对原子质量为12.01
D.该元素没有同位素,所有原子的中子数均为6
难度: 中等查看答案及解析
-
合成氨工业为人类解决粮食问题做出了巨大贡献。一定条件下,在密闭容器中进行合成氨反应:N2(g) + 3H2(g)
2NH3(g),当正、逆反应速率相等且不等于零时,下列说法不正确的是
A.N2、H2完全转化为NH3
B.N2、H2、NH3在容器中共存
C.反应已达到化学平衡状态
D.N2、H2、NH3的浓度不再改变
难度: 中等查看答案及解析
-
下列有关原电池的说法中不正确的是
A. 在内电路中,电子由正极流向负极 B. 原电池的正、负极材料不一定都参与反应
C. 原电池工作时,正极上发生还原反应 D. 原电池工作时,可能会伴随着热能变化
难度: 简单查看答案及解析
-
对于某反应X+3Y=2E+2F在甲、乙、丙、丁四种不同条件下。分别测得反应速率为甲:Vx=0.3mol·L-1·min-1;乙:VY=1.2mol·L-1·min-1;丙:VE=0.8mol·L-1·min-1;丁:VF=0.9mol·L-1·min-1,则反应最快的是 ( )
A.甲 B.乙 C.丙 D.丁
难度: 困难查看答案及解析
-
下列有关化学用语表示正确的是
A. 次氯酸的结构式: H—Cl—O B. 1H、2H、3H是同一种核素
C. S2-的结构示意图:
 D. 四氯化碳的电子式:
D. 四氯化碳的电子式: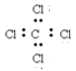
难度: 简单查看答案及解析
-
下列叙述中,正确的是
A. 某物质中只含有一种元素,该物质一定是纯净物
B. 含有共价键的化合物一定是共价化合物
C. 含有离子键的化合物一定是离子化合物
D. 离子化合物只含离子键
难度: 中等查看答案及解析
-
已知反应X+Y= M+N为吸热反应,下列说法中正确的是
A.X的能量一定低于M的,Y的能量一定低于N的
B.因为该反应为吸热反应,故一定要加热反应才能进行
C.破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D.X和Y的总能量一定低于M和N的总能量
难度: 中等查看答案及解析
-
控制变量法是化学实验的常用方法之一。下图实验探究影响反应速率的因素是

A. 浓度 B. 温度 C. 催化剂 D. 固体质量
难度: 中等查看答案及解析
-
短周期元素X和元素Y,元素X原子的最外层电子数为a,次外层电子数为b;元素Y原子的M层电子数为(a-b),L层电子数为(a+b),则X、Y两元素形成的化合物可能具有的性质是
A. 和水反应 B. 和硫酸反应 C. 和氢氧化钠反应 D. 和氯气反应
难度: 中等查看答案及解析
-
下图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、W、R是其中的五种元素。下列说法不正确的是

A. 原子半径:Y>X B. 最高价氧化物的水化物的酸性:R>W
C. 气态氢化物的稳定性:X>W D. 单质与水(或酸)反应的剧烈程度:Z>Y
难度: 中等查看答案及解析
-
下列有关金属及金属材料的说法不正确的是
A. 合金的性能一般优于纯金属
B. 碳素钢是目前用量最大的合金,碳素钢在空气中比纯铁耐腐蚀
C. 酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成一层致密的氧化膜
D. 用金属铝与V2O5反应冶炼钒,主要是因为铝的还原能力比钒强
难度: 简单查看答案及解析
-
研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是

A.OC段离子反应方程式:H++OH-=H2O
B.溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
C.溶液中n(
)=0.012 mol
D.欲测定F点沉淀的质量,实验步骤是过滤、洗涤、干燥、称量
难度: 简单查看答案及解析