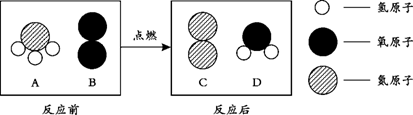
-
下列变化中,属于化学变化的是
A.干冰升华 B.酒精燃烧 C.铁丝弯曲 D.西瓜榨汁
难度: 中等查看答案及解析
-
空气的成分中,体积分数约占78%的是
A.氮气 B.氧气 C.二氧化碳 D.稀有气体
难度: 中等查看答案及解析
-
决定元素种类的是
A.质子数 B.中子数 C.电子数 D.最外层电子数
难度: 中等查看答案及解析
-
下列物质属于纯净物的是
A.生铁 B.碘酒 C.白磷 D.矿泉水
难度: 中等查看答案及解析
-
下列物质在氧气中燃烧,火星四射、生成黑色固体的是
A.木炭 B.镁条 C.红磷 D.铁丝
难度: 中等查看答案及解析
-
下列物质中,属于溶液的是
A.糖水 B.牛奶 C.米粥 D.豆浆
难度: 中等查看答案及解析
-
下列数据为常见水果的近似pH,其中呈碱性的是

A.柿子pH = 8.5 B.菠萝pH = 5.1 C.苹果pH = 4.1 D.杨梅pH=2.5
难度: 中等查看答案及解析
-
喝牛奶可以补钙,这里的“钙”指的是
A.分子 B.原子 C.元素 D.单质
难度: 中等查看答案及解析
-
核电站中可用硼酸(H3BO3)吸收中子,阻断核辐射。硼酸中硼元素的化合价是
A.+1 B.+2 C.+3 D+4
难度: 中等查看答案及解析
-
下列化学方程式中,书写正确的
A.C + O2 = CO2 B.4P + 5O2
2P2O5[
C.Zn + HCl = ZnCl2 + H2 D.H2SO4 + NaOH = NaSO4 + H2O
难度: 中等查看答案及解析
-
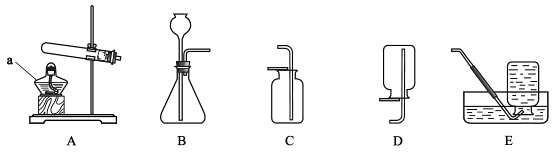
下列实验基本操作中,正确的是
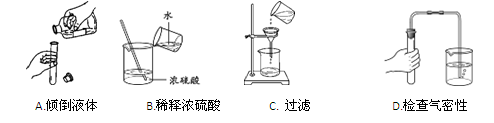
难度: 中等查看答案及解析
-
下列做法中,不利于保护水资源的是
A.使用节水型马桶 B.合理使用农药和化肥
C.生活污水任意排放 D.工业废水处理达标后排放
难度: 中等查看答案及解析
-
下列能保持氢气化学性质的是
A.H B.H+ C.H2 D.2H
难度: 中等查看答案及解析
-
农作物缺钾时,抗病虫害和抗倒伏能力降低,此时应该施用的化肥是
A.KCl B.CO(NH2)2 C.NH4Cl D.Ca3(PO4)2
难度: 中等查看答案及解析
-
下列物质敞口放置于空气中,质量会增加的是
A.食盐水 B.石灰石 C.浓盐酸 D.浓硫酸
难度: 中等查看答案及解析
-
压瘪的乒乓球放入热水中重新鼓起,是因为球内的气体分子
A.体积增大 B.质量增大 C.间隔增大 D.个数增多
难度: 中等查看答案及解析
-
酒精监测仪中的反应原理为:C2H5OH+4X(红色)+ 6H2SO4 = 2Cr2 (SO4)3(绿色) + 2CO2↑+ 9H2O,则物质X的化学式为
A.CrO3 B.Cr2O3 C.Cr2S3 D.CrSO3
难度: 中等查看答案及解析
-
下图为元素周期表中钚元素的相关信息,下列说法不正确的是
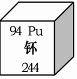
A.钚是金属元素 B.钚原子核外有94个电子
C.钚元素的中子数为150 D.钚的相对原子质量为244g
难度: 中等查看答案及解析
-
下列实验设计能达到实验目的的是
选项
A
B
C
D
实
验
设
计

实验
目的
验证CO2与H2O反应生成H2CO3
探究可燃物燃烧的两个条件
测定空气中O2的含量
验证质量守恒定律
难度: 中等查看答案及解析
-
下列物质的用途中,利用其物理性质的是
A.氧气用于炼钢 B.活性炭可作吸附剂
C.小苏打用于焙制糕点 D.熟石灰可用于改良酸性土壤
难度: 中等查看答案及解析
-
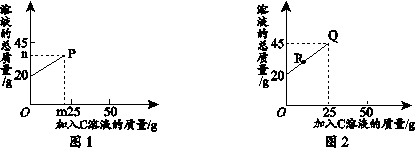
根据下图溶解度曲线,判断下列说法正确的是
A.t1℃时,甲的溶解度大于乙
B.t2℃时,甲、乙两溶液的溶质质量分数一定相等
C.t3℃时,将甲、乙的饱和溶液都蒸发掉10g水,甲析出的晶体质量大
D.把t1℃时甲、乙的饱和溶液升温至t3℃时,两溶液的溶质质量分数都会增大
难度: 中等查看答案及解析
-
下列有关物质的检验、鉴别、除杂、分离所用的试剂或方法正确的是
选项
实验目的
所用试剂或方法
A
检验一瓶气体是否为CO2
燃着的木条
B
鉴别氢氧化钠溶液和饱和石灰水
升高温度
C
除去NaOH溶液中的Na2CO3
稀盐酸
D
分离铁粉和铜粉混合物
稀硫酸
难度: 中等查看答案及解析
-
下列4个图像能正确反映对应变化关系的是
A
B
C
D
向一定量NaOH溶液中加水
向一定量不饱和KNO3溶液中逐渐加入KNO3固体
向一定量澄清石灰水中加入Na2CO3溶液
向等质量的Mg、MgO中加入稀盐酸
难度: 中等查看答案及解析
-
下图中甲、乙、丙是3种不同类别的物质,且均能与X发生化学反应。若X为稀盐酸,则甲、乙、丙3种物质可能为
A.Fe、CuO、Cu(OH)2 B.Fe、CaCO3、Na2CO3
C.Zn、Fe2O3、Na2SO4 D.Cu、Ca(OH)2、CaCO3
难度: 中等查看答案及解析
-
太阳能光伏发电”能有效推行“低碳经济”的发展,其最关键的材料是高纯硅(Si)。三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法。生产流程示意图如下:

下列说法正确的是
A.三氯甲硅烷(SiHCl3)属于有机物
B.上述流程中可循环使用的物质是H2、HCl
C.“精馏”是蒸馏的一种,其原理是利用混合物成分的密度不同
D.从粗硅到SiHCl3(粗)的化学反应方程式为:Si + HCl
SiHCl3 + H2
难度: 中等查看答案及解析