-
化学基本概念是化学知识的重要组成部分。
(1)在“盐析”、“ 升华”、“蒸馏”、 “干馏”这几个名词概念中,与化学变化有关联的是__________。
(2)在①氯水、②七水硫酸锌、③水玻璃、④王水这几种与“水”相关的物质概念中,表示纯净物的是_____(填写序号)
(3)“胶体”是化学基本概念之一。实验室通常采用向沸水中逐滴加入________的方法来制备Fe(OH)3胶体,生成Fe(OH)3胶体的化学方程式可表示为____________。若向所制得的Fe(OH)3胶体中逐滴加入稀硫酸至过量,可以观察到的现象是____________。
(4)“氧化还原”、“反应介质”等也是化学中常用的基本概念。重铬酸钾(K2Cr2O7)是一种比较强的氧化剂,但用它的水溶液在常温及酸性介质中与双氧水混合制备蓝色晶态CrO5的反应却是一个非氧化还原反应,请写出该反应的离子方程式______________。CrO5的名称是过氧化铬,则每个CrO5的分子中含有的过氧键数目为_______________
-
氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题:

(1)下列有关NH3的说法中,不正确的是__________(双选)。
A.工业合成NH3需要在高温高压下进行 B. NH3可用来生产碳铵和尿素等化肥
C. NH3可用浓硫酸或无水氯化钙干燥 D. NH3受热易分解,须置于冷暗处保存
(2)NH3易于水,标准状况下,用充满NH3的烧瓶做喷泉实验,水充满整个烧瓶后所形成溶液的物质的量浓度为__________mol.L-1。
(3)氨气燃烧的化学方程式为_______________。
(4)HNO3是一种重要的化工原料,工厂生产出的浓硝酸可用铝槽车或铁槽车来运输。在常温下能使铝、铁钝化,说明浓硝酸具有很强的______________性。
(5)“吸收塔” 尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的破坏作用,通常用以下两种方法处理:
①纯碱溶液吸收法。纯碱溶液与NO2的反应原理为:
Na2CO3+2NO2=NaNO3+________+CO2 (请填写完成化学方程式)。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为__________,若用通式NOx表示氧化物,则每摩尔氨可将________mol的NOx转化为N2。
-
根据元素在周期表中的位置能推测元素的原子结构以及相关物质的性质。下图是元素周期表的一部分,请根据图中字母所示元素的位置回答问题。

(1)元素W在周期表中所处的位置是______________;元素P的原子结构示意图为__________; :元素Y的最高价氧化物的电子式为________________。
(2)元素M和N的单质中还原性较强的是_________(填元素符号,下同):元素Y、Z、W的非金属性由强到弱的顺序为_______________。
(3)元素Z、N、T形成的简单离子中,半径由大到小的顺序为____________(填离子符号)。
(4)下列说法中,正确的有______________。
①元素Y的单质有多种同素异形体②M2Z中仅含离子键,M2Z2中仅含共价键
③X2T和M2Z都是离子化合物 ④X2Z比X2T的沸点更高
(5)X、Z、M、T可形成含Z原子个数不同的两种常见酸式盐(均含四种元素),这两种酸式盐在溶液中相互反应的离子方程式为____________________。
-
产自我国西北某盐湖的“块碱”是一种Na2CO3和NaCl的混合物。可通过以下方法对块碱样品的组成和含量进行分析测定。
Ⅰ.定性测定NaCl的存在:
(1)取样品少许溶于水,加入足量稀硝酸充分反应后再滴加____________溶液,能观察到有___________产生,说明块碱中含有NaCl。
Ⅱ.定量测定Na2CO3的含量:
准确称量w g样品置于如下装置中,向其中加入足量稀硫酸,通过测定生成气体的体积来求算Na2CO3的含量。请回答下列相关问题:

(2)测定装置中,导管a的作用是_____________________。
(3)为提高测定的准确度,溶液b最宜选用__________________。
①饱和食盐水
②饱和NaHCO3溶液
③澄清石灰水
④酸性KMnO4溶液
(4)若根据所取样品的质量估计反应时产生的气体体积最多在30mL左右,则产生气体前对量气装置读数时,装置内的装液量和液面调节最为合理的是_____________(填虚线框中对应这的字母编号)。
(5)用你以上所选出的最为合理的读数为起点,若终点读数为17.60mL,则反应所产生的气体的测定体积为_________mL。若实验温度下的气体摩尔体积为VmL.mol-1,由此可得出样品中Na2CO3的含量
表达式为:Na2CO3%=___________%。
-
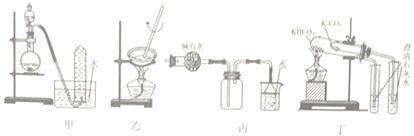
铁有两种氯化物,都是重要的化工试剂,一些性质及制备方法如下:
氯化铁:熔点306℃,沸点315℃,易吸收空气中的水分而潮解。工业上采用向500〜600℃的铁粉中通入氯气来生产无水氯化铁。
氯化亚铁:熔点670℃,易升华。工业上采用向炽热铁粉中通入氯化氢来生产无水氯化亚铁。实验室可用下图所示的装置模拟工业生产无水氯化铁,请回答相关问题。

(1)装置A用于KMnO4固体与浓盐酸反应制氯气,反应的离子方程式为______________。
(2)弯曲的a管所起的作用是_____________;装置采用较粗的导管来连接装铁粉的硬质玻璃管和广口瓶C,其目的是____________________。
(3)导管b 口应与 (从虚线框装置中选择装置的字母序号)连接,这样可避免反应系统与环境间的相互影响。
(4)实验完成后,取广口瓶C中收集到的产物进行如下测定分析:
①称取4.52g样品溶于过量的稀盐酸中:②加入足量H2O2;③再加入足量NaOH溶液:④过滤、洗涤后灼烧沉淀;⑤称量所得红棕色固体为2.40g。则该样品中Fe元素的质量分数为________%。
(5)由上分析数据和计算得出结论:用此装置制得的无水氯化铁含铁最偏高,显然其中含有较多的FeCl2杂质。
①产生FeCl2杂质的原因是___________________。
②若要得到较纯净的无水氯化铁,可采取的装置改进措施是______________________。
2Cu+SO2,有关该反应的说法正确的是



