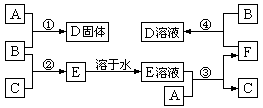
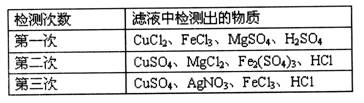
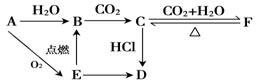
-
下列物质组别,不属于同素异形体的是
A.O2和O3 B.白磷和红磷 C.金刚石和C60 D.H2O和H2O2
难度: 中等查看答案及解析
-
下列化学反应中,属于氧化还原反应的是
A.Na2CO3+2HCl=2NaCl+CO2↑+H2O B.CaO+H2O=Ca(OH)2
C. 2CO +O2
2CO2 D. CaCO3
CaO+CO2↑
难度: 中等查看答案及解析
-
在有水参加的下列氧化还原反应中,水既不是氧化剂又不是还原剂的是
A. C+H2O(气)
CO+H2 B. Cl2+H2O=HCl+HClO
C. 2F2+2H2O=4HF+O2 D.2Cl2+2H2O=4HCl+O2
难度: 中等查看答案及解析
-
下列物质不能与二氧化碳反应的是
A. NaHCO3溶液 B. Na2CO3溶液 C. CaCO3溶液 D.NaOH溶液
难度: 中等查看答案及解析
-
只用哪一种试剂就可将AgNO3、KSCN、稀H2SO4 、NaOH 四种无色溶液区分开
A.FeCl3溶液 B.FeCl2溶液 C.BaCl2溶液 D.Fe(NO3)3溶液
难度: 中等查看答案及解析
-
下列说法中正确的是
A.氧化剂发生氧化反应 B.还原剂发生还原反应
C.失电子的元素化合价降低 D.得电子的元素化合价降低
难度: 中等查看答案及解析
-
下列物质与铁反应的生成物,能与KSCN 溶液反应生成红色溶液的是
A.盐酸 B. 稀硫酸 C. 氯气 D. 硫酸铜溶液
难度: 中等查看答案及解析
-
下列中和反应对应的离子方程式能以H+ + OH- =H2O来表示的是
(A)醋酸和氢氧化钠溶液反应 (B)氢氧化钠溶液和稀硫酸反应
(C)氢氧化钡和稀硫酸反应 (D)氢氧化镁和盐酸反应
难度: 中等查看答案及解析
-
要除去氯化铁中少量的氯化亚铁,可行的是
A. 通入氯气 B. 滴入KSCN 溶液 C.加入铜粉 D.加入铁粉
难度: 中等查看答案及解析
-
下列各组离子能在溶液中大量共存的是
A、HCO3―、Na+、OH―、K+ B、CO32―、Ba2+、K+、NO3―
C、Ba2+、OH―、Cl―、Na+ D、CO32―、Na+、NO3―、H+
难度: 中等查看答案及解析
-
CO2通入下列溶液中,不可能产生沉淀的是
A. 饱和Na2CO3溶液 B.石灰水
C. Ba(OH)2溶液 D. CaCl2
难度: 中等查看答案及解析
-
要证明某溶液中不含Fe3+而可能含有Fe2+。进行如下实验操作时最佳顺序为
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③① C.①②③ D.③②
难度: 中等查看答案及解析
-
下列有关四大基本类型的反应与氧化还原反应的关系的分析正确的是
A.化合反应一定是氧化还原反应 B.分解反应一定是氧化还原反应
C.置换反应一定是氧化还原反应 D.复分解反应一定是氧化还原反应
难度: 中等查看答案及解析
-
初中化学教材中“家庭小实验”是利用家庭日常生活用品进行化学学习和探究的活动。食盐、食醋、纯碱等均为家庭厨房中常用的物质,利用这些物质你能完成的实验是
①检验自来水中是否含氯离子 ②鉴别食盐和纯碱 ③检验鸡蛋壳能否溶于酸 ④除去热水瓶中的水垢
A.①②③④ B.②③④ C.②④ D.①③
难度: 中等查看答案及解析
-
可以用来鉴别Na2CO3溶液和NaHCO3溶液最好的是
A、加CaCl2溶液 B、加热 C、加稀盐酸 D、加澄清的石灰水
难度: 中等查看答案及解析
-
下列说法正确的是
A.CO2 无毒,对大气不造成污染,所以可以无限量排放
B.NaHCO3 比Na2CO3 稳定
C.Na2CO3 溶液可与Ba(OH)2 溶液反应,NaHCO3 溶液不与Ba(OH)2 溶液反应
D.NaHCO3 溶液与NaOH 溶液混合会发生反应,但观察不到明显的现象
难度: 中等查看答案及解析
-
氮化铝(AlN,Al和N的相对原子质量分别为27和14)广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:Al2O3+N2+3C
2AlN+3CO合成。下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.AlN的摩尔质量为41 g
C.AlN中氮的化合价为+3
D.上述反应中,每生成1 mol AlN需转移3 mol电子
难度: 中等查看答案及解析
-
下列除杂所选用的试剂(括号内为杂质)及操作方法均正确的一组是
选项
待提纯的物质
选用的试剂
操作方法
A
NaOH(Na2CO3)
盐酸
-
B
CO2(CO)
CuO
加热
C
Fe (Zn)
稀硫酸
过滤
D
CO2(HCl)
Na2CO3溶液
洗气
难度: 中等查看答案及解析
-
某无色混合气体可能含有CO2、CO、H2O(气)、H2中的一种或几种,依次进行下列处理(假设每次处理均反应完全):①通过碱石灰,气体体积变小,②通过灼热的氧化铜时,固体全部变为红色,③通过白色硫酸铜粉末时,粉末变为蓝色,④通过澄清石灰水,溶液没有明显现象。由此可以确定混合气体中
A.一定含有CO2、H2O,可能含有H2、CO
B.一定含有H2,不含CO, 至少含有H2O、CO2中的一种
C.一定含有H2,不含CO,不可能含有H2O
D.一定含有CO、H2,可能含有H2O、CO2
难度: 中等查看答案及解析
-
根据反应式:⑴Br2 + 2I— = 2Br- + I2 ⑵Cl2 + 2Br—= Br2+ 2Cl-可判断离子的氧化性由强到弱的顺序是
A.Cl2、Br2、I2 B. Br2、Cl2、I2
C.I2 、 Cl2、Br2 D.I2 、Br2、Cl2
难度: 中等查看答案及解析
-
运用有关碳酸钠和碳酸氢钠的知识判断下列说法中正确的是
A. 碳酸氢钠的热稳定性比碳酸钠的强
B. 等质量的碳酸钠、碳酸氢钠分别与足量的盐酸反应,前者产生的二氧化碳多
C. 等物质的量的碳酸钠和碳酸氢钠分别与足量盐酸反应,前者消耗的盐酸多
D. 足量的碳酸钠和碳酸氢钠分别与等物质的量的盐酸反应,两者产生的二氧化碳一样多
难度: 中等查看答案及解析