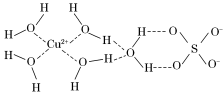
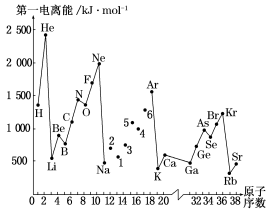
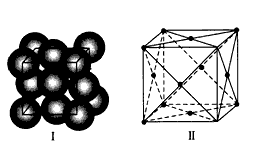
-
区分晶体和非晶体最可靠的科学方法是
A.观察外观是否规则 B.测定是否有固定的熔点
C.进行X射线衍射实验 D.验证是否有各向异性
难度: 简单查看答案及解析
-
符号为M的能层所含的能级有几种
A.2 B.3 C.8 D.18
难度: 简单查看答案及解析
-
下列分子中,属于非极性分子的是
A.SO2 B.BeCl2 C.CH3Cl D.COCl2
难度: 中等查看答案及解析
-
下列说法中正确的是
A.基态原子是处于最低能量状态的原子
B.C原子的电子排布式不可能是1s22s12p3
C.焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱
D.同一原子处于激发态时的能量一定低于基态时的能量
难度: 中等查看答案及解析
-
下列基态原子的电子排布图中,正确的是

难度: 中等查看答案及解析
-
下列说法正确的是
A.钾(K)原子基态的原子结构示意图为
B.Ca2+电子排布式为1s22s22p63s23p64s2
C.原子核内有10个中子的氧原子可表示为O
D.H2O分子的电子式为
难度: 中等查看答案及解析
-
下列各组晶体中化学键类型和晶体类型均相同的是
A.二氧化硅和二氧化碳 B.金刚石和石墨
C.氯化钠和过氧化钠 D.铁和铜
难度: 简单查看答案及解析
-
下列物质中,难溶于CCl4的是
A.碘单质 B.氯化氢 C.苯 D.甲烷
难度: 简单查看答案及解析
-
关于晶体的下列说法正确的是
A.晶体中的化学键都具有饱和性和方向性
B.晶体中只要有阴离子,就一定有阳离子
C.石墨是一种典型的原子晶体
D.冰中存在极性共价键和氢键两种化学键
难度: 中等查看答案及解析
-
下列关于σ键和π键的理解不正确的是
A.σ键一般能单独形成,而π键一般不能单独形成
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.CH3—CH3、CH2===CH2、CH≡CH中σ键都是C—C键,所以键能都相同
D.碳碳双键中有一个σ键,一个π键,碳碳三键中有一个σ键,两个π键
难度: 中等查看答案及解析
-
下列不能形成配位键的组合是
A.Ag+、NH3 B.BF3、NH3 C.Co3+、H2O D.Ag+、H+
难度: 中等查看答案及解析
-
下列物质的熔、沸点高低顺序正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅 B.CI4>CBr4>CCl4>CF4
C.NH3>H2O>N2>CO D.生铁>钠>纯铁
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.离子化合物中一定不含非极性共价键
B.原子晶体的熔点一定高于其他晶体
C.金属晶体的堆积方式的空间利用率最低的是Po
D.构成晶体的粒子一定含有化学键
难度: 中等查看答案及解析
-
下列排列顺序正确的是
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子能力:OH->CH3COO->Cl-
①③ B.②④ C.①④ D.②③
难度: 中等查看答案及解析
-
已知C3N4晶体具有比金刚石还大的硬度,且构成该晶体的微粒间只以单键结合。下列关于C3N4晶体说法错误的是
A.该晶体属于原子晶体,其化学键比金刚石更牢固
B.该晶体中每个碳原子连接4个氮原子、每个氮原子连接3个碳原子
C.该晶体中碳原子和氮原子的最外层都满足8电子结构
D.该晶体与金刚石相似,都是原子间以非极性键形成空间网状结构
难度: 中等查看答案及解析
-
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A.质子数c>d,离子的还原性Y2->Z-
B.氢化物的稳定性H2Y>HZ
C.原子半径X<W,第一电离能X<W
D.电负性Z>Y>W>X
难度: 中等查看答案及解析
-
某化学学习小组在学习元素周期系和周期的划分时提出了以下观点:
①周期系的形成是由原子的结构决定的;
②元素周期系中IA族元素统称为碱金属元素;
③每一周期的元素原子外围电子排布均是从nsl开始至ns2np6结束;
④元素周期系的每一周期元素的种类均相等;
⑤基态原子电子排布为ls22s22p3和ls22s22p63s23p3的两元素原子位于同一周期;
⑥周期序号越大,该周期所含金属元素一般越多。
你认为正确的是
A.①②③⑤⑥ B.①⑥ C.①④⑥ D.②③⑤
难度: 中等查看答案及解析
-
通常把原子总数和价电子总数相同的分子或离子称为等电子体。人们发现等电子体的空间结构相同,则下列有关说法中正确的是
A.CH4和NH4+是等电子体,键角均为60°
B.NO3-和CO32-是等电子体,均为平面正三角形结构
C.H3O+和PCl3是等电子体,均为三角锥形结构
D.B3N3H6和苯是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道
难度: 困难查看答案及解析
-
下列现象与氢键有关的是
①NH3的熔、沸点比第Ⅴ A族相邻元素的氢化物高
②小分子的醇、羧酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④尿素的熔、沸点比醋酸的高
⑤邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑥NH3分子加热难分解
A.①②③④⑤⑥ B.①②③④⑤
C.①②③④ D.①②③
难度: 中等查看答案及解析
-
下列说法中正确的是
A.PCl3分子是三角锥形,这是因为P原子是以sp2杂化的结果
B.sp3杂化轨道是由任意的1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
C.凡中心原子采取sp3杂化的分子,其VSEPR模型都是四面体
D.AB3型的分子立体构型必为平面三角形
难度: 中等查看答案及解析
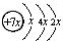 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题: