-
从石墨中分离出来的石墨烯是已知最薄、最坚硬的物质,可制成电阻率最小的纳米材料,其结构如图所示。下列关于石墨烯的说法正确的是
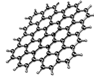
A.具有良好的导电性 B.属于高分子化合物
C.与金刚石互为同位素 D.不能与氧气发生反应
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.CSO的电子式:
B.甲酸甲酯的结构简式:C2H4O2
C.S2-离子的结构示意图:
D.中子数为145、质子数为94的钚(Pu)原子:Pu
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.pH<7的溶液中:SO42—、CO32—、Na+、K+
B.使酚酞变红色的溶液中:Na+、K+、Cl-、CH3COO-
C.0.1 mol·L-1 NH4Al(SO4)2溶液中:AlO2—、Mg2+、Cl-、SO42—
D.c(H+)/c(OH-)=1012的溶液中:Na+、Ba2+、NO3—、ClO-
难度: 困难查看答案及解析
-
下列物质性质与应用对应关系正确的是
A.氯化镁属于电解质,工业上可用电解其溶液的方法制镁
B.钠钾合金的硬度小,可用作快中子反应堆的热交换剂
C.Fe2O3是红棕色固体,可以制成红色的油漆、涂料
D.溴单质在CCl4中的溶解度大,可用CCl4萃取Br-
难度: 中等查看答案及解析
-
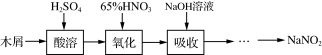
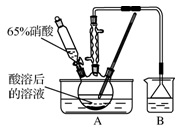
实验室中用下列装置进行相应实验,能达到实验目的的是
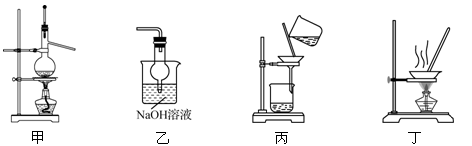
A.用装置甲以乙醇和浓硫酸为原料制乙烯
B.用装置乙吸收某些实验尾气中的二氧化硫
C.用装置丙分离Cl2与KI溶液反应生成的碘
D.用装置丁蒸干NH4Cl饱和溶液获取NH4Cl晶体
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.常温下,0.1 mol·L-1醋酸钠溶液中含有Na+和CH3COO-的总数为0.2NA
B.常温下,将0.1 mol铁片放入足量浓硝酸中反应后,转移电子的数目为0.3NA
C.2 g NO2和44 g N2O4的混合气体中所含原子的总数为3NA
D.0.1 mol甘油醛中含有双键的数目为0.3NA
难度: 中等查看答案及解析
-
下列指定反应的离子方程式书写正确的是
A.用白醋除铁锈:Fe2O3·xH2O+6H+=(3+x)H2O+2Fe3+
B.向Ba(OH)2溶液中加入少量的NH4HSO4溶液:Ba2++2OH-+NH4++H++SO42—=BaSO4↓+NH3·H2O+H2O
C.纯碱溶液和苯酚反应:CO32—+2C6H5OH→2C6H5O-+CO2↑+H2O
D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2=I2+2OH-
难度: 困难查看答案及解析
-
下表各组物质中,通过一步反应不能实现如图所示转化的是
选项
a
b
c
A
Al2O3
NaAlO2
Al(OH)3
B
CO2
Na2CO3
NaHCO3
C
NO
NO2
HNO3
D
Fe2O3
FeCl3
FeCl2
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W、M的原子序数依次增大,其中Y和W的原子序数相差8,W原子最外层电子数是Z原子最外层电子数的2倍,Y、Z、W三种原子的最外层电子数之和为15,X的最高正价和最低负价的代数和为0。下列说法正确的是
A.原子半径的大小顺序:r(W)>r(Z)>r(Y)
B.元素Z、M的简单离子的电子层结构相同
C.W的简单气态氢化物的热稳定性比M的差
D.元素X和Y形成的化合物只有一种
难度: 中等查看答案及解析
-
已知:2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) ΔH1
2CO(g)+O2(g)===2CO2(g)ΔH2
2H2(g)+O2(g)===2H2O(l)ΔH3
2H2(g)+O2(g)===2H2O(g)ΔH4
CO(g)+2H2(g)===CH3OH(g)ΔH5
下列关于上述反应焓变的判断正确的是
A.ΔH1>0,ΔH2<0 B.ΔH3>ΔH4
C.ΔH1=ΔH2+2ΔH3-ΔH5 D.2ΔH5+ΔH1<0
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.电解精炼铜时,电解液CuSO4溶液的物质的量浓度不变
B.NaClO溶液中通入少量CO2后,ClO-水解程度增大,溶液碱性增强
C.SO3(g)+H2O(l)===H2SO4(aq)在常温下能自发进行,则该反应的△H<0
D.0.1 mo1·L-1 CH3COOH溶液加水稀释后,溶液中
的值减小
难度: 中等查看答案及解析
-
一种抗高血压的药物甲基多巴的结构简式如图所示,下列说法正确的是
A.1 mol甲基多巴的分子中含有4 mol双键
B.每个甲基多巴分子中含有一个手性碳原子
C.1 mol甲基多巴最多能与2 mol Br2发生取代反应
D.甲基多巴既能与盐酸反应,又能与氢氧化钠溶液反应
难度: 中等查看答案及解析
-
在检验用FeCl3溶液生产铜制印刷线路板后所得的废液成分的实验中,下列根据实验现象得出的结论不正确的是
A.向废液中加入少量的葡萄糖溶液,无红色沉淀产生,说明废液中不含Cu2+
B.向废液中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明废液中含有Cl-
C.向废液中加少量铁粉,充分反应后无固体剩余,说明废液中含有Fe3+
D.向废液中滴加KSCN溶液,无现象,再加入氯水后溶呈血红色,说明废液中含有Fe2+
难度: 困难查看答案及解析
-
室温下,用0.10 mol·L-1盐酸分别滴定20.00 mL 0.10 mol·L-1氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积[V(HCl)]的变化关系如图所示。下列说法不正确的是
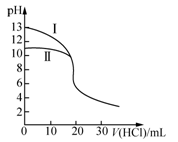
A.Ⅱ表示的是滴定氨水的曲线,当V(HCI)=20 mL时,有:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B.当pH=7时,滴定氨水消耗的V(HCl)=20 mL,且c(NH4+)=c(Cl-)
C.滴定氢氧化钠溶液时,若V(HCl)>20 mL,则一定有:c(Cl-)>c(Na+)>c(H+)>c(OH-)
D.当滴定氨水消耗V(HCl)=10 mL时,有:2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O)
难度: 极难查看答案及解析
-
一定温度下(T1<T2),在三个体积均为2.0 L的恒容密闭容器中发生反应:CO(g)+2H2(g)
CH3OH(g)
容器编号
温度/℃
起始物质的量/mol
平衡物质的量/mol
CO
H2
CH3OH(g)
Ⅰ
T1
0.2
0.4
0.18
Ⅱ
T1
0.4
0.8
Ⅲ
T2
0.2
0.4
0.16
下列说法正确的是
A.该反应的正反应为放热反应
B.达平衡时,容器Ⅰ中CH3OH(g)的体积分数比容器Ⅱ中的大
C.采取加压、增大c(H2)、加入合适的催化剂等措施,都能提高CO的转化率
D.若起始时向容器Ⅰ中充入CO 0.2 mol、H2 0.2 mol、CH3OH(g)0.5 mol,则反应将向正反应方向进行
难度: 困难查看答案及解析