-
对Na、Mg、Al的有关性质的叙述正确的是
A. 碱性:NaOH<Mg(OH)2<Al(OH)3 B. 第一电离能:Na<Mg<Al
C. 电负性:Na>Mg>Al D. 还原性:Na>Mg>Al
难度: 中等查看答案及解析
-
共价键、离子键和范德华力是粒子之间的三种作用力。现有下列晶体:①Na2O2 ②SiO2 ③石墨 ④金刚石 ⑤NaCl ⑥白磷,晶体中含有两种作用力的是
A.①②③ B.①②③⑥ C.②④⑥ D.①③⑥
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.冰融化时水分子中共价键发生断裂
B.H2O2、PCl5都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的酸性依次增强
D.H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 中等查看答案及解析
-
有6种物质:①乙烷;②丙炔;③环己烯;④苯;⑤甲苯;⑥聚乙烯。其中常温下,既不能使酸性KMnO4溶液褪色,也不能与溴水反应使溴水褪色的是( )
A. ①③④ B. ①④⑥ C. ①④⑤ D. ②③⑤
难度: 简单查看答案及解析
-
某元素的原子3d能级上有1个电子,它的N能层上电子数是( )
A. 0 B. 2 C. 5 D. 8
难度: 简单查看答案及解析
-
下列原子或离子原子核外电子排布不属于基态排布的是( )
A. N:1s22s22p3 B. S2-:1s22s22p63s23p6
C. Na:1s22s22p53s2 D. Si:1s22s22p63s23p2
难度: 中等查看答案及解析
-
下列有关化学键与晶体结构的说法正确的是
A. 两种元素组成的分子中一定只有极性键
B. 离子化合物的熔点一定比共价化合物的高
C. 含有阴离子的化合物一定含有阳离子
D. 非金属元素组成的化合物一定是共价化合物
难度: 中等查看答案及解析
-
下列物质性质变化规律正确的是
A. HI、HBr、HCl、HF的沸点依次降低 B. O、F、H的原子半径依次减小
C. 干冰、钠、冰的熔点依次降低 D. 金属Na、Mg、Al的硬度依次降低
难度: 中等查看答案及解析
-
下列有关晶体的说法中正确的是
A. 氯化钾溶于水时离子键未被破坏 B. 分子间作用力越大,分子越稳定
C. 冰融化时分子中共价键发生断裂 D. 原子晶体中共价键越强,熔点越高
难度: 中等查看答案及解析
-
下列描述中正确的是( )
A. 氮原子的价电子排布图:
B. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
C. 2p和3p轨道形状均为哑铃形,能量也相等
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
难度: 中等查看答案及解析
-
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
元素
I1
I2
I3
I4
X
500
4600
6900
9500
Y
780
1300
2100
11600
A. 若元素Y处于第三周期,它可与冷水剧烈反应 B. 元素X的常见化合价是+1
C. 元素Y是ⅢA族元素 D. 元素X与氯形成化合物时,化学式可能是XCl
难度: 中等查看答案及解析
-
下列分子中的中心原子的杂化方式为sp杂化,分子的空间构型为直线形且分子中没有形成π键的是( )
A. C2H2 B. CO2 C. BeCl2 D. SO2
难度: 中等查看答案及解析
-
下列各物质的晶体中,晶体类型相同的是( )
A. CCl4与H2O B. SiO2和CO2 C. NaCl与金刚石 D. MgCl2与Na
难度: 中等查看答案及解析
-
下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是
物质
NaCl
AlF3
AlCl3
MgCl2
CO2
SiO2
熔点/℃
801
1291
190(2.5×105Pa)
714
-56.5
1723
A. AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B. AlF3晶体的晶格能小于NaCl晶体的晶格能
C. 同族元素的氧化物可以形成不同类型的晶体
D. 不同族元素的氯化物可以形成相同类型的晶体
难度: 困难查看答案及解析
-
某物质的晶体中,含A、B、C三种元素,其排列方式如图所示(其中前后两面心上的B原子不能画出),
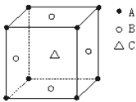
晶体中A、B、C的原子个数比依次为
A.1:3:1 B.2:3:1
C.2:2:1 D.1:3:3
难度: 中等查看答案及解析
-
①正丁烷 ②2-甲基丙烷 ③正戊烷 ④2-甲基丁烷 ⑤2,2-二甲基丙烷五种物质,以下说法正确的是( )
A. ①、③无支链,且分子中碳原子共直线 B. 沸点比较:⑤>④>③>②>①
C. ①、 ②、③互为同系物 D. ③、④、⑤互为同分异构体
难度: 中等查看答案及解析
-
联苯的结构简式如右图(
),下列有关联苯的说法中正确的是( )
A. 它和蒽(
)同属于芳香烃,两者互为同系物
B. 联苯的一氯代物有4种
C. 1mol联苯最多可以和6molH2发生加成反应
D. 它容易发生加成反应、取代反应,也容易被强氧化剂(如:酸性KMnO4溶液)氧化。
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的组成为CnH2n
B. 等质量的烃CxHy完全燃烧耗氧量的多少取决于y/x的值的大小,y/x的值越大,耗氧量越多
C. 某气态烃CxHy与足量O2恰好完全反应,如果反应前后气体体积不变(温度>100℃),
则y=4;若体积减少,则y<4;否则y>4
D. 质量相同的两种有机物完全且充分燃烧产生等量的二氧化碳,则这两种有机物中碳元素的质量分数一定相同
难度: 困难查看答案及解析
-
鲜花保鲜剂S-诱抗素制剂,可保证鲜花盛开。S-诱抗素的分子结构如下图,下列关于该物质的说法不正确的是( )
A. 其分子式为C14H20O4
B. 该物质中含有3种含氧官能团
C. 既能发生加成反应,又能发生取代反应
D. 既能使紫色石蕊试剂显红色,又能使酸性KMnO4溶液褪色
难度: 中等查看答案及解析
-
某烃与氢气发生反应后能生成(CH3)2CHCH2CH3,则该烃不可能是( )
A. 2-甲基-2-丁烯 B. 3-甲基-1-丁炔
C. 2-甲基-2-丁炔 D. 2-甲基-1,3-丁二烯
难度: 困难查看答案及解析