-
PM 2.5是指大气中直径小于或等于2.5微米(1微米=10-6米)的可入肺颗粒物,下列对PM2.5无影响的是
A.风力发电 B.汽车尾气 C.煤炭燃烧 D.建筑扬尘
难度: 简单查看答案及解析
-
下列物质在工业生产中,其主要反应不涉及氧化还原反应的是
A.烧碱 B.纯碱 C.硫酸 D.硝酸
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是
A.32g甲醇中含有C-H键的数目为4NA
B.1L0.1mol·L-1的氨水含有0.1NA个OH-
C.10L pH=1的硫酸溶液中含有的H+数为2NA
D.H2S和SO2气体混合生成0.3mol单质硫时,转移电子的数目为0.4NA
难度: 中等查看答案及解析
-
有机物
的一氯代物种类有(不考虑立体异构)
A.5种 B.6种 C.7种 D.8种
难度: 中等查看答案及解析
-
下列说法正确的是
A.Fe3O4根据化合价规律可表示为FeO·Fe2O3,则Pb3O4也可表示为PbO·Pb2O3
B.CaC2能水【解析】
CaC2 + 2H2O = Ca(OH)2 + C2H2 ↑,则Al4C3也能水【解析】
Al4C3 + 12H2O = 4A1(OH)3↓+ 3CH4↑C.Cl2与Fe加热生成FeCl3,则I2与Fe加热生成FeI3
D.SO2通入BaCl2溶液不产生沉淀,则SO2通入Ba(NO3)2溶液也不产生沉淀
难度: 中等查看答案及解析
-
某有机物结构简式如图所示,下列说法正确的是
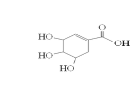
A.分子式为C7H6O5
B.分子中含有两种官能团
C.可发生加成反应和取代反应
D.1mol该有机物能与4molNaOH反应
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.氯气与水反应:Cl2 + H2O = 2H+ + Cl- + ClO-
B.硫化亚铁与稀硝酸反应:FeS + 2H+ = Fe2+ + H2S↑
C.碳酸氢钠溶液与稀硫酸反应:HCO3- + H+ = H2O + CO2↑
D.检验氯化亚铁溶液是否变质:Fe2++ 2SCN- = Fe(SCN)2
难度: 中等查看答案及解析
-
短周期元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列说法不正确的是
A.X是钠元素
B.离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最强
D.同周期元素中Y的非金属性最强
难度: 中等查看答案及解析
-
钠铝合金(常温液态)可作核反应堆的载热介质,下列说法错误的是
A.该合金的熔点低于金属钠的熔点
B.若将钠铝合金投入水中得到无色溶液且无固体剩余,则n(Na)≥n(Al)
C.若将钠铝合金投入FeCl3溶液有Fe(OH)3沉淀生成
D.等质量的钠铝合金中铝含量越大,与足量盐酸反应时放出的氢气越少
难度: 中等查看答案及解析
-
部分弱酸的电离平衡常数如下表:
弱酸
HCOOH
HCN
H2CO3
电离平衡常数(25℃)
K=1.77×10-4
K=4.9×10-10
K1=4.2×10-7
K2=5.6×10-11
下列说法正确的是
A.CN- + H2O + CO2 = HCN + HCO3-
B.0.1mol·L-1HCOONa溶液比0.1mol·L-1NaCN溶液的pH大
C.用0.1mol·L-1NaOH溶液中和等浓度的HCN和HCOOH时前者所需NaOH溶液体积大
D.0.1mol·L-1NaHCO3溶液中粒子浓度的大小:c(Na+)> c(HCO3-)>c(H+)>c(OH-)
难度: 中等查看答案及解析
-
下列说法正确的是
A.除去苯中混有的少量苯酚,可加入浓溴水后过滤
B.除去乙酸乙酯中混有的少量乙酸,可加入饱和碳酸钠溶液分液
C.除去NaHCO3溶液中的Na2CO3,可加入Ca(OH)2溶液后过滤
D.除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤
难度: 中等查看答案及解析
-
加热21.2g KOH和KHCO3的混合物使其充分反应后冷却,称得固体质量减少1.8g,则
下列说法中正确的是(n表示物质的量)
A.n(KOH) = 0.1mol B.n(KOH) < n(KHCO3)
C.n(KHCO3) = 0.2mol D.n(KOH) > n(KHCO3)
难度: 中等查看答案及解析
-
用电解法制取KIO3的方法是以石墨和铁为电极电解KI溶液,电解反应方程式为
KI + 3H2O
KIO3 + 3H2↑。下列说法中正确的是
A.电解时石墨作阴极
B.电解时阳极上产生H2
C.电解过程中阴极区溶液pH升高
D.阴极电极反应式:I-- 6e-+ 3H2O = IO3-+ 6H+
难度: 中等查看答案及解析
-
在硫酸、明矾和硫酸铝组成的混合溶液中,c(Al3+)=0.3 mol·L-1,c(SO42-)=0.7mol·L-1, 由水电离的c(H+)=10-13 mol·L-1,则c(K+)为
A.0.15mol·L-1 B.0.2mol·L-1 C.0.3mol·L-1 D.0.4mol·L-1
难度: 中等查看答案及解析
-
下列指定分散系中能大量共存的微粒是
A.空气: CH4、CO2、SO2、NO
B.银氨溶液: Na+、H+、NO3-、NH4+
C.pH=2的溶液: H+、K+、Cl-、Br-
D.高锰酸钾溶液: H+、Na+、SO42-、HCOOH
难度: 中等查看答案及解析
-
某温度下,向一定体积0.1mol/L醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH( pOH=-lgc(OH-) )与pH的变化关系如图所示,则
A.N点所示溶液中c(H+) < c(OH-)
B.M点所示溶液导电能力强于Q点
C.M点水的电离程度大于N点
D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
难度: 中等查看答案及解析
-
下列叙述正确的是
A.NaHSO4溶于水,只破坏了离子键
B.稀醋酸加水稀释,电离程度增大,溶液的酸性增强
C.饱和石灰水中加入少量CaO,恢复至室温后溶液pH不变
D.沸水中滴加适量饱和FeCl3溶液可制得氢氧化铁沉淀
难度: 中等查看答案及解析
-
下列有关α-氨基酸的说法中错误的是
A.结构简式一般可用下图表示
B.在酸溶液中主要以阳离子形式存在
C.在碱溶液中主要以阴离子形式存在
D.加聚反应可生成蛋白质
难度: 中等查看答案及解析
-
在一个不导热的密闭反应器中,只发生两个反应:
A(g)+B(g)
2C(g);△H < 0
X(g)+3Y(g)
2Z(g);△H > 0
进行相关操作且达到平衡,下列叙述正确的是
A.等压时,通入惰性气体,C的物质的量增大
B.等压时,通入X气体,反应器中温度不变
C.等容时,通入惰性气体,各反应速率不变
D.等容时,通入X气体,Y的物质的量浓度增大
难度: 中等查看答案及解析
-
已知在25℃时,氯化银的Ksp=1.8×10-10,现将足量氯化银分别放入下列溶液中,相同温度下c(Ag+)最大的是
A.100mL蒸馏水 B.100mL 0.2mol·L-1 AgNO3
C.100 mL 0.1mol·L-1AlCl3 D.100mL 0.1 mol·L-1 盐酸
难度: 中等查看答案及解析
-
一定温度下有可逆反应:A(g)+2B(g)
2C(g)+D(g) 。现将5molA和10molB加入一体积为2L的密闭容器中,反应至10min时改变某一条件,C的物质的量浓度随时间变化关系如图所示。
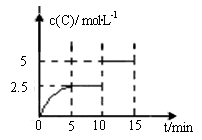
下列有关说法正确的是
A.在0~5min内,正反应速率逐渐增大
B.反应从起始至5min时,B的转化率为50%
C.5min时的平衡常数与10min时的平衡常数不等
D.第15min时,B的体积分数为25%
难度: 中等查看答案及解析
-
已知Cu+在酸性条件下能发生下列反应:Cu+ → Cu + Cu2+(未配平)。NH4CuSO3与足量的10mol·L-1硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②有刺激性气味气体产生 ③溶液呈蓝色。据此判断下列说法一定合理的是
A.气体是二氧化硫 B.NH4CuSO3中铜元素全部被氧化
C.反应后为硫酸铜溶液 D.硫酸全部作氧化剂
难度: 中等查看答案及解析