-
下列说法正确的是
A. 煤经过气化和液化两个物理变化,可变为清洁能源
B. 现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
C. 明矾净水时发生了化学及物理变化,能起到净水作用,而没有杀菌、消毒的作用
D. 用活性炭为糖浆脱色和用次氯酸盐漂白纸浆的原理相同
难度: 中等查看答案及解析
-
物质制备过程中离不开物质的提纯。以下除杂方法正确的是
选项
目的
试验方法
A
除去Na2CO3固体中的NaHCO3
置于蒸发皿中加热至恒重
B
除去NaCl中少量KNO3
将混合物制成热饱和溶液,冷却结晶,过滤
C
除去CO2中的HC1
通过NaHCO3(aq•饱和),然后干燥
D
除去Al2O3固体中的Fe2O3
加入足量氢氧化钠溶液后过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列溶液中:①澄清石灰水②氯化钡溶液③KMnO4溶液④溴水⑤酸化的Ba(NO3)溶液⑥品红溶液⑦湿润的蓝色石蕊试纸⑧三氯化铁溶液⑨浓硫酸,不能用来区别SO2和CO2气体的是
A. ①②⑦⑨ B. ①③⑧ C. ①④⑤ D. ③④⑤⑥
难度: 困难查看答案及解析
-
下列有关实验操作的叙述错误的是( )
A. 过滤操作中,漏斗的尖端应接触烧杯内壁
B. 从滴瓶中取用试剂时,滴管的尖嘴可以接触试管内壁
C. 滴定接近终点时,滴定管的尖嘴可以接触锥形瓶内壁
D. 向容量瓶转移液体时,导流用玻璃棒可以接触容量瓶内壁
难度: 简单查看答案及解析
-
利用下列装置和操作不能达到实验目的的是( )
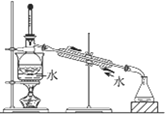



A.从含碘CCl4溶液中提取碘和回收CCl4溶剂
B.萃取操作过程中的放气
C.定量测定化学反应速率
D.比较KMnO4、Cl2、S的氧化性
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列叙述正确的是(用NA代表阿伏加德罗常数的值)
A. 2.4g金属镁变为镁离子时失去的电子数为0.1NA
B. 1molHCl气体中的粒子数与0.5mol/L 盐酸中溶质粒子数相等
C. 将1molCl2通入水中,HClO、Cl-、ClO-粒子数之和为2NA
D. 在标准状况下,22.4LCH4与18gH2O所含有的电子数均为10NA
难度: 中等查看答案及解析
-
下列实验操作能达到目的的是
实验目的
实验操作
A
制备Fe(OH)3胶体
将NaOH浓溶液滴加到饱和FeCl3溶液中
B
配制氯化铁溶液
将氯化铁溶解在较浓的盐酸中再加水稀释
C
确定Na2SO3样品是否部分被氧化
取样于试管中,加入稀硝酸酸化,再滴加BaCl2溶液,观察是否有白色沉淀生成
D
证明反应速率会随反应物浓度的增大而加快
用3mL稀硫酸与足量纯锌反应,产生气泡速率较慢,然后加入lmLlmol·L-1CuSO4溶液,迅速产生较多气泡
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列离子组在一定条件下能大量共存且加入相应试剂后所对应的离子方程式正确的是
选项
离子组
加入试剂
加入试剂后发生反应的离子方程式
A
Fe2+、NO3-、K+
稀硫酸
3Fe2+ +NO3-+4H+=3Fe2++NO↑+2H2O
B
Fe3+、I-、ClO-
氢氧化钠溶液
Fe3++3OH-=Fe(OH)3↓
C
Ca2+、HCO3-、Cl-
氢氧化钠溶液
HCO3-+OH- =CO32-+H2O
D
Al3+、Cl-、NO3-
过量氢氧化钠液
A13++3OH-=Al(OH)3↓
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
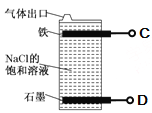
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是
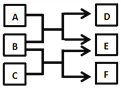
A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
难度: 困难查看答案及解析
-
将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合充分反应后,取混合液分别完成下列实验,能说明溶液中存在化学平衡2Fe3++2I-
2Fe2++I2的是
实验编号
实验操作
实验现象
①
滴入KSCN溶液
溶液变红色
②
滴入AgNO3溶液
有黄色沉淀生成
③
滴入K3[Fe(CN)6]溶液
有蓝色沉淀生成
④
滴入淀粉溶液
溶液变蓝色
A. ①和③ B. ②和④ C. ③和④ D. ①和②
难度: 中等查看答案及解析
-
右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是
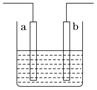
A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
难度: 中等查看答案及解析
-
常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10mol·L-1CH3COOH溶液和HCN溶液所得滴定曲线如下图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
C. 点④所示溶液液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
难度: 困难查看答案及解析
-
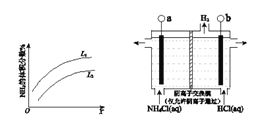
利用甲烷燃料电池电解饱和食盐水制备漂白液,下列说法中不正确的是( )
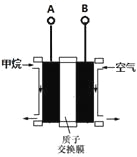
A. 燃料电池的A极连接电解池的C极
B. A电极的电极反应式为:CH4-8e-+2H2O = CO2+8H+
C. 燃料电池工作时H+移向左边
D. 电解池总反应式为NaCl+H2O
NaClO+H2↑
难度: 中等查看答案及解析
-
部分弱酸的电离平衡常数如下表所示:
弱酸
HCOOH
HCN
H2CO3
电离平
衡常数(25℃)
K=1.77×10-4
K=4.9×10-10
K1=4.3×10-7
K2=5.6×10-11
下列选项正确的是
A. 2CN-+H2O+CO2=2HCN+CO32-
B. 中和等体积、等PH的HCOOH和HCN消耗NaOH的量前者大于后者
C. c(H+)相等的HCOONH4溶液、NH4CN溶液、NH4HCO3溶液中:c(NH4HCO3)>c(NH4CN)>c(HCOONH4)
D. 物质的量浓度相等的HCOONa和KCN溶液中,c(Na+)-c(HCOO-)+)-C(CN-)
难度: 困难查看答案及解析
-
在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g)
3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

A. Q点时,Y的转化率最大
B. W点X的正反应速率等于M点X的正反应速率
C. 升高温度,平衡常数增大
D. 温度一定,平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
难度: 简单查看答案及解析
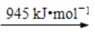 2N(g) Cl2(g)
2N(g) Cl2(g)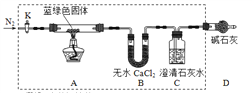

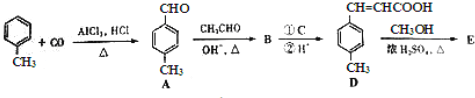
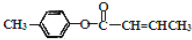 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方 程式为___________________
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方 程式为___________________