-
化学与生活密切相关,下列说法正确的是( )
A. 石油分馏、煤的干馏、烟气脱硫、菜籽中提取菜籽油等过程都是物理变化
B. “China”来源于闻名于世的中国陶瓷,陶瓷是一种硅酸盐产品
C. 高纯度的硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
D. 绚丽缤纷的烟花中添加了含铁、铂、钠、钾、铜等金属化合物
难度: 中等查看答案及解析
-
下列有关化学用语正确的是( )
A. 次氯酸的结构式:H-Cl-O B. 原子核内有10个中子的氧原子:
C. F原子结构示意图:
D. MgCl2的电子式:
难度: 中等查看答案及解析
-
下列有机化学反应方程式及反应类型均正确的是( )
选项
化学反应方程式
反应类型
A
CH3COOH+CH3CH2OH
CH3COOCH2CH3
取代反应
B
CH4+Cl2
CH3Cl+HCl
置换反应
C
CH3CH=CH2+Br2 CH2BrCH2CH2Br
加成反应
D
+Br2
+HBr
取代反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
氧可与多种元素形成化合物,设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )
A. 7.2 g CaO2晶体中阴离子数目为0.2NA
B. 4.0 g H
O中所含电子数为2NA
C. 6.2 g Na2O溶于100 mL水中所得溶液的物质的量浓度为2 mol·L-1
D. 标准状况下,将22.4 L Cl2通入足量水中发生反应,转移电子的数目为NA
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 漂白粉、铝热剂、盐酸、聚乙烯都是混合物
B. CO2、H2O、SO2、HClO都是氧化物
C. 胶体区别于其他分散系的本质特征是丁达尔效应
D. 糖类、油脂和蛋白质都属于天然高分子化合物
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A. Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-===2Fe2++I2+3H2O
B. 0.1 mol·L-1 NH4Al(SO4)2溶液与0.2 mol·L-1 Ba(OH)2溶液等体积混合:Al3++2SO
+2Ba2++4OH-===2BaSO4↓+AlO
+2H2O
C. 向0.1 mol·L-1、pH=1的NaHA溶液中加入NaOH溶液:HA-+OH-===A2-+H2O
D. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O===HClO+HSO
难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系 ,下列有关物质的推断不正确的是( )。
A. 若甲为AlCl3,则丁可能是NaOH B. 若甲为N2,则丁可能是O2
C. 若甲为Fe,则丁可能是硝酸 D. 若甲为NaOH溶液,则丁可能是CO2
难度: 中等查看答案及解析
-
某溶液中含有的离子可能是K+、Ba2+、Al3+、Mg2+、AlO
、CO
、SiO
、Cl-中的几种,现进行如下实验:
①取少量溶液加氢氧化钠溶液过程中无沉淀生成
②另取少量原溶液,逐滴加入5 mL 0.2 mol·L-1盐酸,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生气体,最后沉淀逐渐减少至消失。
③在上述②沉淀消失后的溶液中,再加入足量的硝酸银溶液可得到白色沉淀。
下列说法中正确的是( )
A. 该溶液中一定不含Ba2+、Mg2+、Al3+、SiO
、Cl-
B. 该溶液中一定含有K+、AlO
、CO
、Cl-
C. 该溶液是否有K+需做焰色反应(透过蓝色钴玻璃片)
D. 可能含有Cl-
难度: 困难查看答案及解析
-
下列说法正确的是( )
A. 失电子越多,还原性越强,得电子越多,氧化性越强
B. 已知①Fe+Cu2+===Fe2++Cu;②2Fe3++Cu===2Fe2++Cu2+,则氧化性强弱顺序为Fe3+>Cu2+>Fe2+
C. 已知还原性:B->C->D-,反应2C-+D2===2D-+C2和反应2C-+B2===2B-+C2都能发生
D. 具有强氧化性和强还原性的物质放在一起就能发生氧化还原反应
难度: 困难查看答案及解析
-
无法达到实验目的的是( )

A. A B. B C. C D. D
难度: 困难查看答案及解析
-
如图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是( )
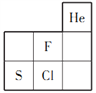
A. 非金属性:F>S>Cl
B. 原子半径:Cl>S>F
C. 稳定性:HF>HCl>H2S
D. 离子半径:Cl->S2->F-
难度: 中等查看答案及解析
-
具有下列性质的有机化合物中同分异构体数目最多的是(不考虑立体异构)( )
选项
A
B
C
D
分子式
C4H8Cl2
C5H10O2
C4H8O2
C9H12
类别
含氯化合物
羧酸
酯
含有苯环的烃
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)
N2(g)+CO2(g)+2H2O(g)ΔH 在温度T1和T2时,分别将0.50 mol CH4和1.2 mol NO2充入体积为1 L的密闭容器中,测得n(CH4)随时间变化数据如下表:
温度
时间/min
0
10
20
40
50
T1
n(CH4)/mol
0.50
0.35
0.25
0.10
0.10
T2
n(CH4)/mol
0.50
0.30
0.18
……
0.15
下列说法正确的是( )
A. 0~10 min内,T1时V(CH4)的平均反应速率比T2时的平均反应速率小
B. T2时,CH4的平衡转化率为35%
C. T1时,40min后,断裂4molC-H键同时生成4molO-H
D. 该反应的ΔH >0,T1<T2
难度: 困难查看答案及解析
-
下列为四个常用的电化学装置,关于它们的叙述正确的是( )
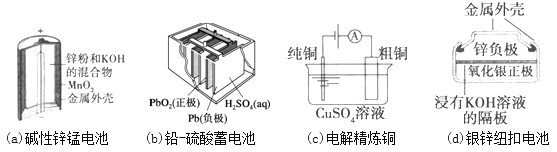
A. 图(a)所示电池中,MnO2的作用是催化剂
B. 图(b)所示电池放电过程中,硫酸浓度不断增大
C. 图(c)所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图(d)所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
难度: 中等查看答案及解析
-
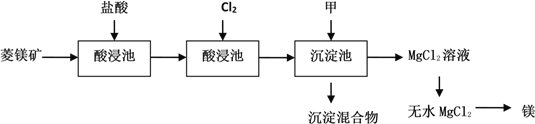
海水综合利用要符合可持续发展的原则,其联合工业体系(部分)如图所示,下列说法错误的是( )
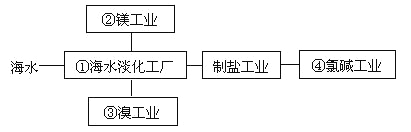
A. ①中可采用蒸馏法
B. ②制镁过程中用到的沉淀剂是石灰乳
C. ③中提溴涉及到复分解反应
D. ④的产品可生产盐酸、漂白液等
难度: 困难查看答案及解析
-
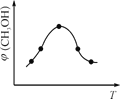
常温下,用0.10mol/LNaOH溶液滴定20.00mL 0.10mol/LHA溶液(滴定曲线见图)。下列说法正确的是( )
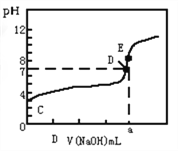
A. 此图可以表示从NaOH滴定盐酸的曲线
B. 图中D点状态时溶液中有:c(Na+)<c(A-)
C. 达到D、E状态时,均有:c(Na+)+c(H+)=c(A-)+c(OH-)
D. 当O<V(NaOH)<20.00mL时,对应混合溶液中各离子浓度由大到小的顺序均为c(A-)> c(Na+)> c(H+)>c(OH-)
难度: 困难查看答案及解析


 。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
。以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下: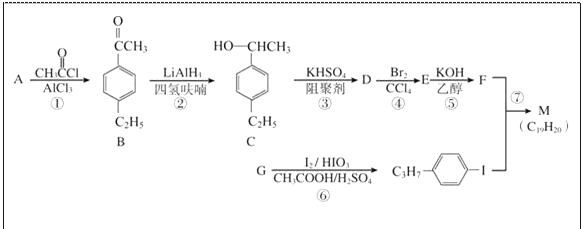
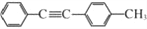 的合成路线: _____________。
的合成路线: _____________。