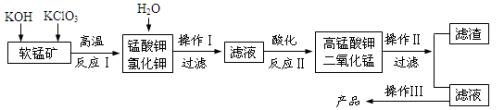
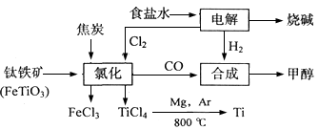
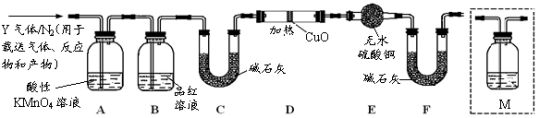
-
最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1mol N-N吸收167kJ热量,生成1mol N
N放出942KJ,

根据以上信息和数据,下列说法正确的是
A.N4属于一种新型的化合物
B.N4与N2互为同位素
C.N4与N2互为同素异形体
D.1mol N4气体转变为N2将吸收882kJ热量
难度: 中等查看答案及解析
-
下列说法正确的是
①经分析某物质只含有一种元素,则该物质一定是单质;
②质子数相同,电子数也相同的粒子,不可能是一种分子和一种离子;
③碱性氧化物一定是金属氧化物;
④NO2不是酸性氧化物、Na2O2不属于碱性氧化物;
⑤两种盐反应一定生成两种新盐。
A.①③④ B.②③④ C.②③⑤ D.①③⑤
难度: 中等查看答案及解析
-
下列物质中,其水溶液能导电,溶于水时化学键被破坏,且该物质属于非电解质的是
A.Cl2 B.SO2 C.NaOH D.C2H5OH
难度: 中等查看答案及解析
-
化学在生产和日常生活中有着重要的应用。下列说法不正确的是
A.明矾水解形成的Al(OH)3胶体能吸附水中的悬浮物,可用于水的净化
B.铅蓄电池放电时铅电极发生氧化反应
C.胶体与溶液的分离可用渗析的方法
D.生铁浸泡在食盐水中发生析氢腐蚀
难度: 简单查看答案及解析
-
同温同压下,等体积的两容器内分别充满由14N、13C、18O三种原子构成的一氧化氮和一氧化碳,下列说法正确的是
A.所含分子数和质量均不相同
B.含有相同的分子数和电子数
C.含有相同的质子数和中子数
D.含有相同数目的中子、原子和分子
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C.向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3= FeO42-+3Cl-+H2O+4H+
难度: 中等查看答案及解析
-
如下图所示,利用海水可提取很多重要的化工原料。
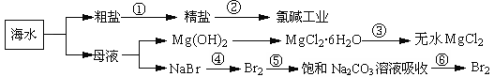
下列有关说法正确的是
A.第①步中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
B.第②步中工业上可采用石墨为阴极,铁为阳极,采用阳离子交换膜的电解装置
C.第③步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2
D.在第④步中溴元素被氧化,第⑤、⑥步中既有溴元素被氧化也有溴元素被还原
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列叙述正确的是
A.1mol羟基与17gNH3所含电子数都为NA
B.12.4g白磷(分子式为P4)中含有P—P共价键0.6NA
C.常温常压下,Na2O2与足量H2O反应,生成了0.2molO2,转移电子的数目为0.8 NA
D.适量铜粉溶解于1L0.5mol·L-1稀硝酸中,当生成2.24LNO时,溶液中氮原子数为0.4 NA
难度: 中等查看答案及解析
-
NaCl是一种化工原料,可以制备一系列物质(如下图所示)。
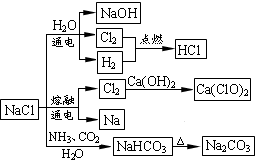
下列说法正确的是
A.石灰乳与Cl2的反应中Cl2既是氧化剂,又是还原剂
B.25℃,NaHCO3在水中的溶解度比Na2CO3的大
C.常温下干燥Cl2能用钢瓶贮运,所以Cl2不与铁反应
D.图中所示转化反应都是氧化还原反应
难度: 中等查看答案及解析
-
Al、Fe、Cu都是重要的金属元素。下列说法正确的是
A.三者对应的氧化物均为碱性氧化物
B.三者的单质放置在空气中均只生成氧化物
C.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
D.电解AlCl3、FeCl3、CuCl2的混合溶液时,阴极上依次析出Cu、Fe、Al
难度: 简单查看答案及解析
-
①①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。
下列结论正确的是
A.①②③均是氧化还原反应
B.氧化性强弱顺序是
C.反应②中氧化剂与还原剂的物质的量之比为6:1
D.反应③中0.1mol还原剂共失去电子数为
难度: 中等查看答案及解析
-
A、B、C、D、E是5种短周期元素,其原子序数依次增大。A是周期表中原子半径最小的元素,B原子最外层电子数是次外层电子数的3倍,C、D、E处于同一周期,E与B处于同一族,C、D原子的核外电子数之和与B、E原子的核外电子数之和相等。下列说法正确的是
A.元素B、C、D具有相同电子层结构的离子,其半径依次增大
B.元素A不能与元素B形成化合物
C.元素B、E分别与元素A形成的化合物的热稳定性:
D.元素D、E的最高价氧化物的水化物都是强酸
难度: 中等查看答案及解析
-
X、Y、Z、M四种金属,已知X可以从Y的盐溶液中置换出Y:X和Z作原电池电极时,Z为正极;Y和Z的离子共存于电解液中,Y离子先放电;M的离子的氧化性强于Y的离子。则这四种金属的活动性由强到弱的顺序为
A.X>Y>Z>M B.X>Z>M>Y C.M>Z>X>Y D.X>Z>Y>M
难度: 简单查看答案及解析
-
如图所示,
,
,
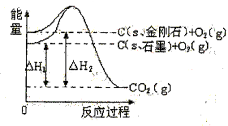
下列说法或表示正确的是
A.
石墨)=
金刚石) △H=+1.9
B.石墨和金刚石的转化是物理变化
C.石墨的稳定性比金刚石弱
D.
石墨的总键能比1mol金刚石的总键能小1.9kJ
难度: 中等查看答案及解析
-
某学生设计了一个“黑笔写红字”的趣味实验(如图)。滤纸先用氯化钠、无色酚酞的混合液浸湿,然后平铺在一块铂片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。
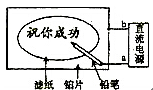
据此,下列叙述正确的是
A.铅笔端作阳极,发生还原反应
B.铂片端作阴极,发生氧化反应
C.铅笔端有少量的氯气产生
D.a点是负极,b点是正极
难度: 中等查看答案及解析