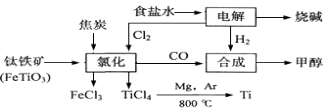-
(12分)某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链。其主要工艺如下:
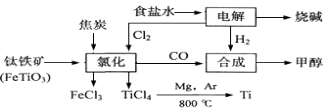
(1)写出工业上电解食盐水反应的化学方程式 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式: 。
(3)已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH= ,反应2Mg+TiCl4 2MgCl4+Ti在Ar气氛中进行的理由是 。
2MgCl4+Ti在Ar气氛中进行的理由是 。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中正极上的电极反应式是 ,负极区的pH (填“增大”、“减小”、“不变”)。
-
(12分)某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链。其主要工艺如下:
(1)写出电解食盐水反应的离子方程式 。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式: 。
(3)已知:①Mg(s) +Cl2(g)=MgCl2(s);ΔH=-641 kJ·mol-1
②Ti(s)+2Cl2(g)=TiCl4(s);ΔH=-770 kJ·mol-1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);ΔH
反应2Mg+TiCl4 2MgCl4+Ti在Ar气氛中进行的理由是 。
2MgCl4+Ti在Ar气氛中进行的理由是 。
(4)在上述产业链中,合成192 t甲醇理论上需额外补充H2 t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式是 。
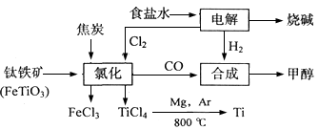
-
某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
(1)写出电解食盐水反应的离子方程式________________________________。阳极上每生成标准状况下的11.2L气体,转移电子的物质的量是_______
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式:____________________。
(3)反应2Mg+TiCl4 2MgCl4+Ti在Ar气氛中进行的理由是__________.
2MgCl4+Ti在Ar气氛中进行的理由是__________.
(4)在上述产业链中,合成192t甲醇理论上需额外补充H2_______t(不考虑生产过程中物质的任何损失)。
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是___________________________.
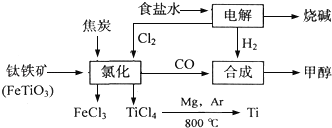
-
某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
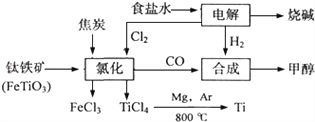
(1)写出钛铁矿经氯化法得到四氯化钛的化学方程式:_____________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=﹣641kJ•mol﹣1
②Ti(s)+2Cl2(g)=TiCl4(s);△H=﹣770kJ•mol﹣1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);△H=___________________________。反应2Mg+TiCl4 2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
(3)在上述产业链中,合成192t甲醇理论上需额外补充H2___________t(不考虑生产过程中物质的任何损失).
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是_____________________________________________________________。
-
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如下图所示。
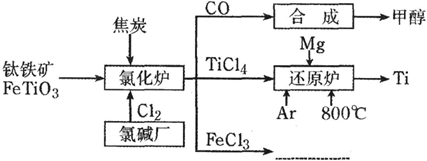
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用___________________;已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶6,则氯化炉中的还原剂化学式是________________________;
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s) △H=-641kJ•molˉ1
② 2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s) △H=-512kJ•molˉ1
则Ti(s)+2Cl2(g)= TiCl4(s) △H=________;
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是_______________________;
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为:2CH3OH+3O2+4OHˉ=2CO32ˉ+6H2O,该电池中负极上的电极反应式是:2CH3OH-12eˉ+16OHˉ=2CO32ˉ+12H2O。则正极上发生的电极反应为:___________。工作一段时间后,测得溶液的pH是____(填“减小”、“增大”或“不变”)。
-
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
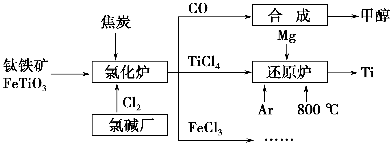
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________;
已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶6,则氯化炉中的还原剂化学式是_________________________________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s) ΔH=-641 kJ·mol-1
②2Mg(s)+TiCl4(s)=2MgCl2(s)+Ti(s) ΔH=-512 kJ·mol-1
则Ti(s)+2Cl2(g)=TiCl4(s) ΔH=________。
(3)Ar气通入还原炉中并不参与反应,通入Ar气的作用是_________________________________________________________________。
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-===2CO32—+6H2O,该电池中正极上的电极反应式为____________________________________________。
工作一段时间后,测得溶液的pH________(填“减小”、“增大”或“不变”)。
-
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
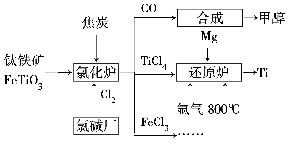
请填写下列空白。
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________
已知氯化炉中氯气和焦炭的理论用料物质的量之比为7∶6,则氯化炉中还原剂的化学式是___________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s)ΔH=-641 kJ/mol
②2Mg(s)+TiCl4(s)= 2MgCl(s)+Ti(s)ΔH=-512 kJ/mol
则Ti(s)+2Cl2(g)=TiCl4(s) ΔH=________。
(3)氩气通入还原炉中并不参与反应,通入氩气的作用是___________________________
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-=2CO32—+6H2O,该电池中正极上的电极反应式为_________________________________________。
工作一段时间后,测得溶液的pH________(填“减小”、“增大”或“不变”)。
-
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
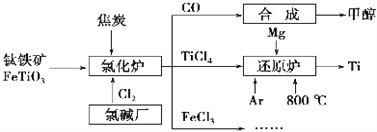
请填写下列空白:
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________;
(2)已知氯化炉中反应氯气和焦炭的理论用料物质的量比为7∶ 6,则氯化炉中的化学方程为_________________________________________________。
(3)TiCl4在常温下为无色液体,在军事上可作为人造烟雾剂,因为它在湿空气中会大冒白烟,水解生成二氧化钛的水凝胶TiO2·xH2O(也常写成H2TiO₃),工业上可也用此反应制备TiO2。请写出该水解方程式__________________________________________(用TiO2·xH2O或H2TiO₃表示均可),工业上用TiCl4制备TiO2·xH2O时要加入大量的水,同时加热,目的是:______________________________
(4)Ar气通入还原炉中并不参与反应,通入Ar气的作用是__________________________
(5)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-= 2CO32-+6H2O,工作一段时间后,测得溶液的pH_____(填“减小”、“增大”或“不变”)。
(6)FeCl3溶液可作为印刷电路铜板的腐蚀液,写出该反应的离子方程式_____________________________
-
当今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)
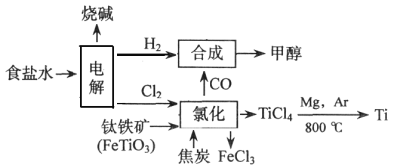
下列叙述正确的是
A. 该流程中只有“电解”、“氯化”涉及氧化还原反应
B. “氯化”时每消耗36g焦炭,则转移7mol电子
C. “合成”反应中氧化剂与还原剂的物质的量之比为1:1
D. 上述流程中“Mg,Ar"可用“Mg,CO2”代替
-
如今环境保护越来越受重视,某化工集团为减少环境污染,提高资源的利用率、将钛厂、氯碱厂、甲醇厂进行联合生产。其主要生产工艺如下:(FeTiO3中Ti为+4价)
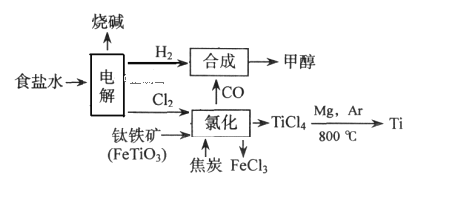
下列叙述正确的是( )
A.该流程中只有“电解”、“氯化”涉及氧化还原反应
B.“合成”反应中氧化剂与还原剂的物质的量之比为1:1
C.“氯化”时反应方程式为7Cl2+2FeTiO3+6C=2FeCl3+2TiCl4+6CO(条件省略)
D.上述流程中“Mg,Ar"可用“Mg,CO2”代替

2MgCl4+Ti在Ar气氛中进行的理由是 。