-
下列环境污染与其产生的原因不相关的是
A B C D
环境污染

白色污染
雾霾
 臭氧空洞
臭氧空洞  酸雨
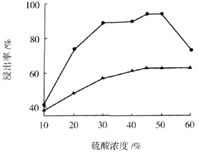
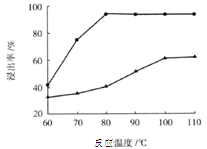
酸雨产生原因 生活污水的排放 汽车尾气的排放 氟利昂的使用 煤的直接燃烧
难度: 中等查看答案及解析
-
实验室保存下列试剂的方法不正确的是
A.钠保存在煤油中
B.用棕色试剂瓶盛放新制的氯
C.用带玻璃塞的试剂瓶盛放NaOH溶液
D.向盛放氯化亚铁溶液的试剂瓶中加少量铁粉
难度: 中等查看答案及解析
-
如图是一个盐桥中充满饱和KCl溶液的锌铜原电池装置,下列分析正确的是
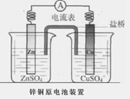
A.Cu片上发生氧化反应
B.电子由Cu片经外电路流向Zn片
C.盐桥中的Cl―移向ZnSO4溶液
D.一段时间后烧杯中c(Zn2+)、c(Cu2+)均减小
难度: 中等查看答案及解析
-
下列关于第IVA族元素的说法中,正确的是
A.原子半径:14Si>32Ge
B.稳定性:CH4<SiH4
C.酸性:H2CO3>H2SiO3
D.碱性:32Ge(OH)4>50Sn(OH)4>82Pb(OH)4
难度: 中等查看答案及解析
-
关于钢铁腐蚀与防护的说法不正确的是
A.钢铁的吸氧腐蚀和析氢腐蚀的负极反应式均为:Fe-2e- = Fe2+
B.钢铁发生吸氧腐蚀时,正极反应式为:O2+2H2O+4e-= 4OH-
C.地下钢管连接镁块是采用牺牲阳极的阴极保护法
D.用外加电流的阴极保护法防止钢铁腐蚀时,钢铁接电源的正极
难度: 中等查看答案及解析
-
向10 mL含等浓度的I-和Cl-的溶液中逐滴加入0.1 mol·L-1的AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如图所示。下列说法不正确的是

A.该实验可以证明AgI比AgCl更难溶
B.加入V2 mL AgNO3溶液后,溶液中不含I-
C.V1= V2-V1
D.向最终的沉淀中加入Na2S溶液,沉淀变成黑色
难度: 中等查看答案及解析
-
如图是模拟工业电解饱和食盐水的装置图,下列叙述正确的是
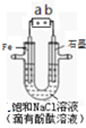
A.a 为电源的正极
B.通电一段时间后,石墨电极附近溶液先变红
C.Fe电极的电极反应是4OH――4e-=2H2O+O2↑
D.电解饱和食盐水的总反应是:2NaCl + 2H2O
2NaOH + H2↑+ Cl2↑
难度: 中等查看答案及解析
-
室温下,对于0.10 mol·L-1的氨水,下列判断正确的是
A.其溶液的pH=13
B.加入少量NaOH,溶液中c(NH4+)减小,Kw减小
C.与AlCl3溶液反应的离子方程式为 Al3++3OH―=Al(OH)3↓
D.滴加0.10 mol·L-1HNO3溶液到pH=7,溶液中离子浓度关系为:c (NO3―) = c(NH4+)> c(H+)=c(OH―)
难度: 中等查看答案及解析
-
下列说法正确的是
A.丙三醇不是乙醇的同系物
B.硫酸铵和醋酸铅溶液均可使鸡蛋清溶液中的蛋白质变性
C.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
D.天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点
难度: 中等查看答案及解析
-
下列方法不能用于鉴别Na2CO3和NaHCO3固体的是
A.分别加热两种固体,将放出的气体通入澄清石灰水
B.分别取两种固体溶于水,滴加Ba(OH)2溶液,观察是否生成沉淀
C.分别取两种固体各 1 g,滴入几滴水振荡,用手触摸试管底部
D.分别取等质量的固体与足量稀盐酸充分反应,加热、蒸干、灼烧称重
难度: 中等查看答案及解析
-
某离子反应中涉及H2O、ClO—、NH4+、H+、N2、Cl—六种微粒。其中N2的物质的量随时间变化的曲线如图所示。下列判断正确的是

A.该反应的还原剂是Cl—
B.消耗1 mol还原剂,转移6 mol电子
C.氧化剂与还原剂的物质的量之比为2:3
D.反应后溶液的酸性明显增强
难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ均正确且有因果关系的是
选项 陈述Ⅰ 陈述Ⅱ
A Fe3+有氧化性 FeCl3溶液可溶解废旧电路板中的铜
B SiO2有导电性 SiO2可用于制备光导纤维
C NH3有还原性 NH3可用H2SO4吸收
D 浓HNO3有酸性 浓HNO3不可用铁制容器盛放
难度: 中等查看答案及解析
-
下列事实、离子方程式及其对应关系均正确的是
A.铁溶于稀硝酸,溶液变为浅绿色:Fe + 4H+ + NO3— = Fe3+ + NO ↑ + 2H2O
B.向K2Cr2O7溶液中滴加少量浓H2SO4,溶液变为黄色:Cr2O72-(橙色) + H2O
2CrO42-(黄色) +2H+
C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝:4H+ + 4I- + O2 =2I2 + 2H2O
D.向水杨酸(
)中滴加NaHCO3溶液,放出无色气体:
+ 2HCO3- →
+ 2CO2↑ + 2H2O
难度: 中等查看答案及解析
-
下列实验中,为实现实验目的而必须除杂的是
实验
除杂试剂
实验目的
①
电石与水反应
CuSO4溶液
用KMnO4酸性溶液检验乙炔的还原性
②
CH3CH2Br与NaOH溶液共热
HNO3溶液
用AgNO3溶液检验CH3CH2Br中的Br
③
淀粉与稀H2SO4水浴共热
NaOH溶液
用银氨溶液检验水解产物的还原性
④
C2H5OH与浓H2SO4加热至170 ℃
NaOH溶液
用Br2的CCl4溶液证明该反应为消去反应
A.只有①②③ B.只有①②④ C.只有②③④ D.①②③④
难度: 中等查看答案及解析
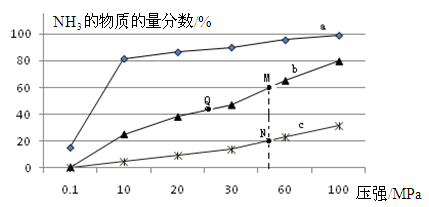
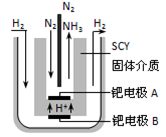 (3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为:
(3)氨是一种潜在的清洁能源,可用作碱性燃料电池的燃料。电池的总反应为: