-
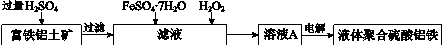
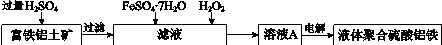
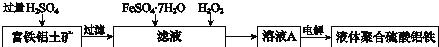
用含有Al2O3及少量Fe2O3和SiO2的铝土矿制备净水剂——液体聚合硫酸铝铁,工艺流程如下(部分操作和条件略):
I.向铝土矿中加入过量H2SO4后,加热、搅拌、过滤。
II.向滤液中加入一定量的FeSO4·7H2O和双氧水。
III.向溶液中加入Ca(OH)2固体,调节溶液的pH约为1,过滤。
IV.加入稳定剂,加热,得到产品。
(1)Fe2O3与H2SO4反应的离子方程式是___________。
(2)步骤I中过滤得到的滤渣成分是________(填化学式)。
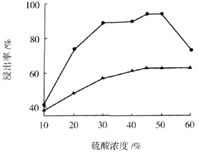
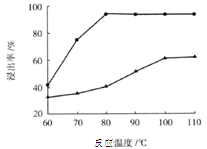
(3)步骤I 中H2SO4的浓度与反应温度会影响铁与铝的浸出率。根据下图分析,步骤I 中H2SO4浓度的适宜范围是__________,反应的适宜温度是_________。

(4)步骤II中增大n(Fe3+)的离子方程式是_________。
(5)步骤III得到碱式硫酸铝铁[AlFe(OH)n(SO4)m]的溶液,则步骤II中应增大n(Fe3+)到
n(Al3+)﹕n(Fe3+)=________。
(6)研究表明,液体聚合硫酸铝铁的纯度越高,净水效果越好。已知:
一些物质在20℃时的溶解度
| 物质 | Ca(OH)2 | CaSO4 | Na2SO4 |
| 溶解度/g | 0.153 | 0.258 | 19.5 |
结合表中数据,解释步骤III中使用Ca(OH)2而不用NaOH的原因__________。
(7)铝土矿也可用于冶炼金属Al。以金属Al作阳极,稀硫酸作电解液,通过电解会使金属Al的表面生成致密坚硬的氧化膜,其电极反应式是_________。
-
富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。研究发现,当a=b时净水效果最好。工艺流程如下(部分操作和产物略):
(1)A12O3与H2SO4发生反应的离子方程式是____________。
(2)测得滤液中 。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)____________。
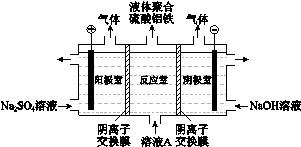
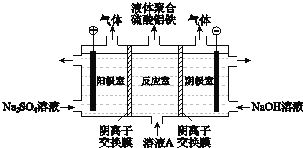
(3)将溶液A电解得到液体聚合硫酸铝铁。装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)
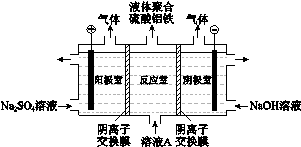
① 阴极室的电极反应式是__________。
② 电解过程阳极室溶液pH的变化是____________(填“增大”、“减小”或“不变”)。
③ 简述在反应室中生成液体聚合硫酸铝铁的原理____________。
-
富铁铝土矿(主要含有A12O3、Fe2O3、FeO和SiO2)可制备新型净水剂液体聚合硫酸铝铁[AlaFeb(OH)m(SO4)n]。研究发现,当a=b时净水效果最好。工艺流程如下(部分操作和产物略):
(1)A12O3与H2SO4发生反应的离子方程式是________。
(2)测得滤液中 。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)________。
。加入FeSO4·7H2O和H2O2的作用是(结合化学用语说明)________。
(3)将溶液A电解得到液体聚合硫酸铝铁。装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)
① 阴极室的电极反应式是________。
② 电解过程阳极室溶液pH的变化是________(填“增大”、“减小”或“不变”)。
③ 简述在反应室中生成液体聚合硫酸铝铁的原理________。
-
(16分)净水剂液体聚合硫酸铝铁兼具铁盐和铝盐的双重絮凝特性,一般是以铁盐为主,铝盐为辅。现用的铝土矿(其主要成分是Al2O3,含有少量杂质Fe2O3和SiO2,其他杂质忽略不计)来制备该净水剂,其工艺流程如下:
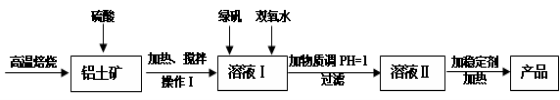
(1)H2SO4浓度的适宜范围是45%~50%,反应的适宜温度是100℃,其目的是: ;Al2O3与H2SO4反应的化学反应方程式是__________。
(2)操作I为:冷却静置、 、洗涤,所得到的溶液I中的金属阳离子有_______(填化学式)。
(3)溶液I中加入绿矾(FeSO4·7H2O)和双氧水的目的是: ,涉及的反应离子方程式为 _ _。
(4)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,请在答题卡中完成钢材镀铝的装置示意图,并作相应标注。

-
富铁铝土矿 主要含有
主要含有 、
、 、FeO和
、FeO和 可制备新型净水剂液体聚合硫酸铝铁
可制备新型净水剂液体聚合硫酸铝铁 研究发现,当
研究发现,当 时净水效果最好.工艺流程如下
时净水效果最好.工艺流程如下 部分操作和产物略
部分操作和产物略 :
:

 与
与 发生反应的离子方程式是 ______ .
发生反应的离子方程式是 ______ .
 测得滤液中
测得滤液中 加入
加入 和
和 的作用是
的作用是 结合化学用语说明
结合化学用语说明 ______ .
______ .
 将溶液A电解得到液体聚合硫酸铝铁.装置如图所示
将溶液A电解得到液体聚合硫酸铝铁.装置如图所示 阴离子交换膜只允许阴离子通过,电极为惰性电极
阴离子交换膜只允许阴离子通过,电极为惰性电极
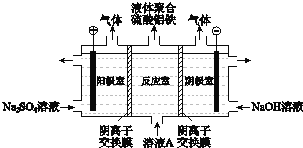
 阴极室的电极反应式是 ______ .
阴极室的电极反应式是 ______ .
 电解过程阳极室溶液pH的变化是 ______
电解过程阳极室溶液pH的变化是 ______  填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” .
.
 简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
-
富铁铝土矿 主要含有
主要含有 、
、 、FeO和
、FeO和 可制备新型净水剂液体聚合硫酸铝铁
可制备新型净水剂液体聚合硫酸铝铁 研究发现,当
研究发现,当 时净水效果最好.工艺流程如下
时净水效果最好.工艺流程如下 部分操作和产物略
部分操作和产物略 :
:
 与
与 发生反应的离子方程式是 ______ .
发生反应的离子方程式是 ______ .
 测得滤液中
测得滤液中 加入
加入 和
和 的作用是
的作用是 结合化学用语说明
结合化学用语说明 ______ .
______ .
 将溶液A电解得到液体聚合硫酸铝铁.装置如图所示
将溶液A电解得到液体聚合硫酸铝铁.装置如图所示 阴离子交换膜只允许阴离子通过,电极为惰性电极
阴离子交换膜只允许阴离子通过,电极为惰性电极
 阴极室的电极反应式是 ______ .
阴极室的电极反应式是 ______ .
 电解过程阳极室溶液pH的变化是 ______
电解过程阳极室溶液pH的变化是 ______  填“增大”、“减小”或“不变”
填“增大”、“减小”或“不变” .
.
 简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
简述在反应室中生成液体聚合硫酸铝铁的原理 ______ .
-
用铝土矿(含30% SiO2、40.8% Al2O3和少量Fe2O3等)制取铝硅合金材料有湿法、干法等方法,其中干法制备的工艺流程如下:
(1)若湿法处理铝土矿,用强酸浸取时,所得溶液中阳离子有 。
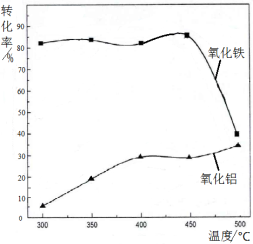
(2)焙烧除铁反应:4(NH4)2SO4 + Fe2O3  2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 ,用电子式表示气体I的形成过程 。
2NH4Fe(SO4)2 + 3H2O + 6NH3↑(Al2O3部分发生类似反应)。氧化物转化为硫酸盐的百分率与温度的关系如图,最适宜焙烧温度为 ,用电子式表示气体I的形成过程 。
(3)操作①包括:加水溶解、 。
(4)用焦炭还原SiO2、Al2O3会产生中间体SiC、Al4C3。写一个高温下中间体与Al2O3反应生成铝单质的化学方程式 。
(5)铝硅合金材料中若含铁,会影响其抗腐蚀性。原因是 。
(6)不计损失,投入1t铝土矿,当加入54kg纯铝后,铝硅合金中m:n = 。
-
利用工业炼铜后的炉渣(含Fe2O3、FeO、SiO2、Al2O3),制备无机高分子絮凝剂聚合氯化铝和净水剂高铁酸钠(Na2FeO4)。其工艺流程如下(部分操作和条件略):
Ⅰ.用稀盐酸浸取炉渣,过滤;
Ⅱ.向滤液中加入过量NaClO溶液,调pH约为3,过滤;
Ⅲ.溶液进行减压蒸发等操作,甩干后送入聚合炉中进行高温聚合,……得到聚合氯化铝。
Ⅳ.将Ⅱ中得到沉淀洗涤、干燥,再与NaClO和NaOH反应,生成高铁酸钠。
(1)稀盐酸溶解Fe2O3的离子方程式是 。
(2)验证炉渣中含有FeO必要的化学试剂为 。
(3)已知:生成氢氧化物沉淀的pH
| 物质 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀时 | 1.5 | 3.4 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 8.3 |
①步骤Ⅱ中加入过量NaClO,反应的离子方程式是 。
②根据表中数据解释步骤Ⅱ中,调pH约为3的目的是 。
(4)该工业流程存在缺点,在步骤Ⅱ伴随着有氯气产生,此反应方程式是 。
(5)步骤Ⅲ中在减压蒸发与甩干操作之间,还需进行的操作是 。
(6)在步骤Ⅳ中,若该反应生成166 g Na2FeO4转移3 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
-
实验室用硫酸厂烧渣(主要成分为Fe2O3及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4•7H2O),有关的工艺流程如下:

(1)将过程②中产生的气体通入下列溶液中,溶液不会褪色的是___________(填编号);
A.品红溶液 B.紫色石蕊溶液
C.酸性KMnO4溶液 D.溴水
(2)在①中已知FeS中铁元素生成Fe3+,S元素生成单质硫,FeS、O2、H2SO4反应的方程式是________;
(3)在③中,需加入的物质是___________________________;
(4)在④中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有_______________________;
(5)在⑥中,将溶液Z控制到70~80℃的目的是________________________________;
(6)为测量聚铁样品中铁元素的质量分数,进行下列实验(假设杂质中不含铁元素和硫元素):称取2.700g样品,将样品溶于足量的盐酸后,滴加过量的BaCl2;过滤、洗涤、干燥,称量固体的质量为3.495g。若该聚铁主要成分为[Fe(OH)(SO4)]n,求该聚铁样品中铁元素的质量分数[Mr (BaSO4) =233、Mr (Fe) =56]。(写出计算过程,结果保留4位有效数字)。
-
铝用途广泛,用铝土矿(主要成分为Al2O3·nH2O、少量SiO2和Fe2O3)制取Al有如下途径:

(1)滤液A可用于净水,其净水原理用离子方程式表示为_________________。
(2)灼烧时盛放药品的仪器名称是______________
(3)步骤Ⅴ中发生反应的化学方程式是________________________。
(4)步骤Ⅲ中生成固体C的离子反应方程式为__________________________。
(5)取滤液B 100 mL,加入1 mol/L盐酸200 mL,沉淀量达到最大且质量为11.7 g。则滤液B中c(Al O2-)=_____________。(4分)














