-
化学与社会、生活、技术和环境密切相关。下列有关说法中不正确的是
A.有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低,极易被引燃,加热时最好用水浴加热
B.石油裂解、海水制镁、纤维素制火棉都包含化学变化
C.大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收
D.苹果放在空气中久置变黄和纸张久置变黄原理相似
难度: 简单查看答案及解析
-
下列有关物质的分离说法正确的是
A.检查是否漏水是滴定管、容量瓶、分液漏斗等仪器使用的第一步操作
B.碘水中加CCl4振荡静置后,上层为紫色,下层几乎为无色
C.可用加热法分离NH4Cl(s)和I2(s)
D.蒸馏、分馏和干馏都是利用组分沸点不同而分离的方法
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是
A.34gH2O2中含有的阴离子数为1NA
B.4.6g乙醇中含有的C-H键的个数为0.6NA
C.标准状况下,VL水含有的氧原子个数约为
D.1molFe2+与足量的H2O2溶液反应,转移NA个电子
难度: 简单查看答案及解析
-
X、Y、Z三种短周期元素,原子半径的大小为:r(Y)> r(X)> r(Z),三种元素的原子序数之和为16。X、Y、Z三种元素的常见单质在在适当条件下可发生右图变化,其中B和C均为10电子分子。下列说法不正确的是

A. X元素位于ⅥA 族 B. A难溶解于B中
C. A和C不可能发生氧化还原反应 D. B的沸点高于C的沸点
难度: 简单查看答案及解析
-
某有机物键线式的结构为
 ,关于其说法正确的是
,关于其说法正确的是A.分子式为C8H10O2
B.可发生氧化、取代、加成反应
C.该有机物的含酯基的芳香族化合物的同分异构体有4种
D.它的另一种同分异构体
 最多有13个原子共平面
最多有13个原子共平面难度: 简单查看答案及解析
-
下列关于电解质溶液的叙述正确的是
A.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(NH4+)>c(H+)=c(OH-)
B.在pH=3的溶液中,Na+、Cl-、Fe2+、ClO-可大量共存
C.常温下,pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中
 增大
增大难度: 简单查看答案及解析
-
在固态金属氧化物电解池中,高温共电解H2O-CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如右图所示。下列说法不正确的是
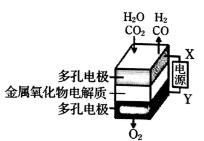
A.阴极的反应式是:H2O+2eˉ=H2+O2ˉ、CO2+2eˉ=CO+O2ˉ
B.X是电源的负极
C.总反应可表示为:H2O+CO2=H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1︰1
难度: 简单查看答案及解析


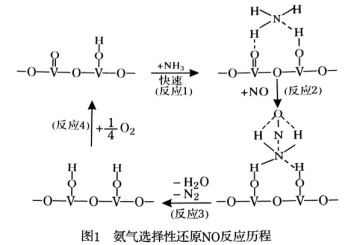
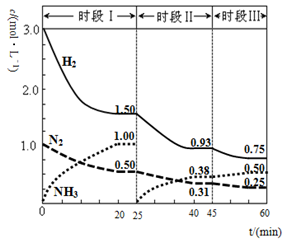
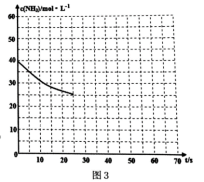
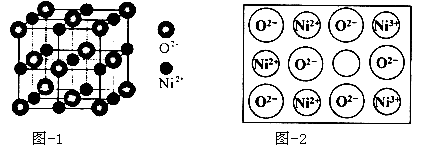

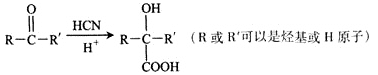
 )的说法正确的是
)的说法正确的是