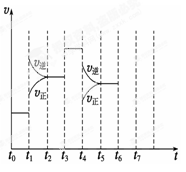
-
下列说法正确的是( )
A.1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热
B.强酸和强碱的稀溶液发生中和反应一定是放热反应,弱酸和弱碱反应一定也是放热反应
C.CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应
D.酸和碱
发生中和反应生成1 mol 水,这时的反应热叫中和热
难度: 中等查看答案及解析
-
已知下列热化学方程式:Zn(s)+
O2(g)=ZnO(s) △H =-351.1kJ·mol-1 ,Hg(l)+
O2(g)=HgO(s) △H =-90.7 kJ·mol-1 由此可知反应Zn(s)+HgO(s)=ZnO(s)+Hg(l)的焓变为(
)
A、-260.4 kJ·mol-1
B、-441.8 kJ·mol-1
C、260.4 kJ·mol-1
D、441.8 kJ·mol-1
难度: 中等查看答案及解析
-
关于原电池和电解池的叙述正确的是( )
A.原电池中失去电子的电极为阴极
B.原电池的负极、电解池的阳极都发生氧化反应
C.原电池的两极一定是由活动性不同的两种金属组成
D.电解时电解池的阴极一定是阴离子放电
难度: 中等查看答案及解析
-
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
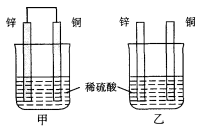
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均增大
D.产生气泡的速度甲比乙慢
难度: 中等查看答案及解析
-
用惰性电极电解CuCl2溶液时,如果阴极上有6.4g铜析出,则阳极上产生气体的体积(标准状况)约为( )
A. 2.24L B. 0.56L C. 0.14L D. 1.12L
难度: 中等查看答案及解析
-
有一处于平衡状态的反应A(g) + 3B(g)
2C(g);△H< 0,为了使平衡向生成C的方向移动,应选择的条件是( )
A 高温低压 B 低温低压 C 低温高压 D 高温高压
难度: 中等查看答案及解析
-
一定温度下,满足下列条件的溶液一定呈酸性的是( )
A.能与金属Al反应放出H2的溶液
B.加酚酞后显无色的溶液
C.pH=6的某溶液
D.c(H+)>c(OH﹣)的任意水溶液
难度: 中等查看答案及解析
-
物质的量浓度相同的下列溶液中,NH4+浓度最大的是( )
A.NH4Cl B. NH4HSO4 C. CH3COONH4 D.NH3•H2O
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为
吸热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
难度: 中等查看答案及解析
-
下列用来表示物质变化的化学用语中,正确的是( )
A.钢铁发生电化学腐蚀的正极反应式:Fe﹣2e﹣=Fe2+
B.HS﹣的水解方程式:HS﹣+H2O
S2﹣+H3O+
C.CO32﹣的水解方程式:CO32﹣+H2O
HCO3﹣+OH﹣
D.AlCl3溶液与Na2CO3溶液混合:2Al3++3CO32﹣=Al2(CO3)3↓
难度: 中等查看答案及解析
-
在2A(g)+B(g)=3C(g)+4D(g)中,表示该反应速率最快的是( )
A.v(A
)=0.5mol•L﹣1.mim﹣1
B.v(
B)=0.3mol•L﹣1.mim﹣1
C.v(C)=0.8mol•L﹣1.mim﹣1
D.v(D)=1.0mol•L﹣1.mim﹣1
难度: 中等查看答案及解析
-
已知反应2A(g)=2B(g)+C(g)△H<0,达平衡时,要使c(A)增大同时使v(正)增大,应改变的条件为( )
A.减小容器容积 B.增大容器容积 C.减小B的浓度 D.降温
难度: 中等查看答案及解析
-
可以证明可逆反应N2+3H2
2NH3已达到平衡状态的是( )
①一个N≡N键断裂的同时,有6个N﹣H键断裂
②v(H2)=0.6mol•L﹣1
•min﹣1,v(NH3)=0.4mol•L﹣1•min﹣1
③保持其他条件不变时,体系压强不再改变;
④NH3、N2、H2的体积分数都不再改变;
⑤恒
温恒容时,混合气体质量保持不变。
A. ②③④ B. ①②④ C. ①③
④ D. ③④⑤
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g)(正反应吸热),下列图象中正确的是( )
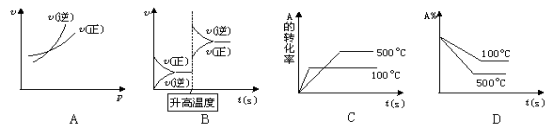
难度: 中等查看答案及解析
-
下列实验操作或对实验事实的叙述中存在错误的是 ( )
A.用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用
B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
C.酸碱中和滴定时,锥形瓶未用待装液润洗。
D.用惰性电极电解NaCl溶液,一段时间后,再加盐酸,可使溶液与原溶液完全一样。
难度: 中等查看答案及解析
-
HA为酸性略强于醋酸的一元弱酸,在0.1 mo
l·L-1 NaA溶液中,离子浓度关系正确的是( )
A.c(Na+)>c(A-)>c(H+)>c(OH-) B.c(Na+)>c(OH-)>c(A-)>c(H+)
C.c(Na+)+c(OH-)=c(A-)+c(H+) D.c(Na+)+c(H+)=c(A
-)+c(OH-)
难度: 中等查看答案及解析