-
己知A、B、C、D是短周期中原子序数依次增大的四种主族元素。A在常温下呈气态,B 原子最外层电子数是其电子层数的2倍,C在同周期的主族元素中原子半径最大,元素D是地壳中含量最多的金属元素。下列说法正确的是
A. A、C的氧化物均含离子键 B. C离子的半径小于D离子的半径
C. A、B可形成多种原子个数比为1:1的化合物 D. 含D元素的盐溶液只能显碱性
难度: 简单查看答案及解析
-
化学与生产生活密切相关,下列有关说法不正确的是
A. 为了防止白色污染应将废旧塑料加以焚烧
B. 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性
C. 富脂禽品包装中常放入活性铁粉袋,以防止油脂氧化变质
D. 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值,下列叙述正确的是
A. 高温下,5.6gFe与足量水蒸气反应,转移的电子数为0.3NA
B. 60g乙酸与足量乙醇发生酯化反应,充分反应后断裂的C-O键数目为NA
C. 100g质量分数为17%的H2O2的水溶液中,极性共价键的数目为NA
D. 室温下向1L pH=1的醋酸溶液中加水稀释,所得溶液中的H+数目大于0.1NA
难度: 中等查看答案及解析
-
分子式为C8H11N的有机物,分子内含有苯环和氨基(—NH2)的同分异构体共有
A.12种 B.13种 C.14种 D.9种
难度: 简单查看答案及解析
-
用下列实验方案及所选玻璃仪器(非玻璃仪器任选)就能实现相应实验目的的是
实验目的
实验方案
所选玻璃仪器
A.
除去KNO3中少量的NaCl
将混合物制成热的饱和溶液,冷却结晶,过滤
酒精灯、烧杯、玻璃棒
B.
海带提碘
将海带剪碎,加蒸馏水浸泡,取滤液加稀硫酸和H2O2
试管、胶头滴管、烧杯、漏斗
C.
测定待测溶液中Fe2+的浓度
量取20.00mL的待测液,用0.1mol/L的KMnO4溶液滴定
锥形瓶、碱式滴定 管、量筒
D.
配制 500mL0.2mol/L CuSO4溶液
将称量好的25.0gCuSO4·5H2O 溶解、冷却、转移、洗涤、定容、 摇匀
烧杯、玻璃棒、量筒、500mL容量 瓶、胶头滴管
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
己知AgCl在水中的溶解是吸热过程。不同温度下,AgCl在水中的沉淀溶解平衡曲线如图所示。己知T1温度下Ksp(AgCl)=1.6×10-9,下列说法正确的是

A. T1>T2
B. a =4.0×10-5
C. M点溶液温度变为T1时,溶液中Cl-的浓度不变
D. T2时饱和AgCl溶液中,c(Ag+)、c(Cl-)可能分别为2.0×10-5mol/L、4.0×10-5mol/L
难度: 中等查看答案及解析
-
氢氧化锂是制取锂和锂的化合物的原料,用电解法制备氢氧化锂的工作原理如图所示,下列叙述不正确的是
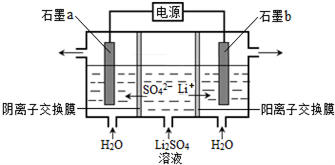
A. b极附近溶液的pH增大
B. a极发生的反应为:2H2O – 4e—= O2↑+4H+
C. 该法制备LiOH还可得到硫酸和氢气等产品
D. 当电路中通过1 mol电子时,可得到2 mol LiOH
难度: 困难查看答案及解析

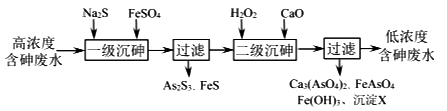

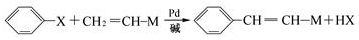 (X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下:
(X为卤原子,M为烃基或含酯基的取代基等),由有机物A合成G(香豆素)的步骤如下: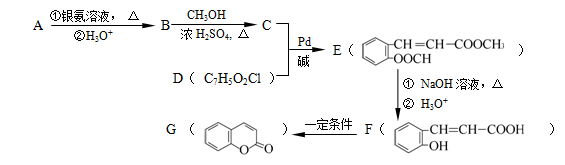
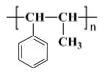 的路线流程图:_________________。
的路线流程图:_________________。