-
某强碱性溶液中,只含有K+、NH4+、Al3+、AlO2-、CO32-、SiO32-、Cl-中的某几种离子,现进行如下实验:①收少量的溶液用硝酸酸化后,该溶液无沉淀生成;②另取一定量原溶液,逐滴加入盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,而后产生一种气体,最后沉淀逐渐减少至全部溶解。③另取一定量的原溶液,加入5mL0.2mol/L 盐酸,沉淀会完全消失,再维续加入足量的硝酸银溶液可得到沉淀0.287g。下列说法一定正确的是
A. 原溶液中含有AlO2-、CO32-、Cl- B. 无法确定原溶液中是否含有Cl-和K+
C. 原溶液中含有Al3+、CO32-、Cl- D. 原溶液中一定不含AlO2-、SiO32-、Cl-
难度: 中等查看答案及解析
-
下列实验方案中,能达到实验目的的是
选项
实验目的
实验方案
A
测同温同浓度下Na2CO3和Na2SO3水溶液的pH
比较碳和硫两种元素非金属性的强弱
B
证明氧化性: H2O2强于Fe3+
用硫酸酸化的H2O2溶液滴入到Fe(NO3)2溶液中,溶液变成黄色
C
证明浓硫酸具有吸水性
在蔗糖中滴加浓硫酸,蔗糖变黑
D
证明醋酸的电离过程吸热
测定稀醋酸和稀NaOH反应的中和热数据,数值小于57.3kJ/mol
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
化学与生产和生活密切相关,下列有关说法正确的是
A. CO2是大量使用的灭火剂,但着火的铁条在CO2中继续燃烧说明它也可以助燃
B. 食用“地沟油”对人体危害很大,但可以通过蒸馏的方式获得汽油、柴油等,实现资源的再利用。
C. 牛奶中加入果汁会产生沉淀,是因为发生了酸碱中和反应
D. 英文的“中国”一词又指“瓷器”,中国瓷器驰名世界,其主要成分是SiO2
难度: 简单查看答案及解析
-
已知气态烃A的密度是相同状况下氢气密度的14倍,有机物A~E能发生下图所示一系列变化,则下列说法错误的是
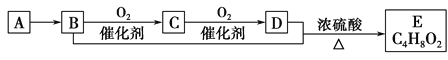
A. A分子中所有原子均在同一平面内
B. C4H8O2含酯基的同分异构体有4种
C. C的水溶液又称福尔马林,具有杀菌、防腐性能
D. 等物质的量的B、D与足量钠反应生成气体的量相等
难度: 困难查看答案及解析
-
二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:
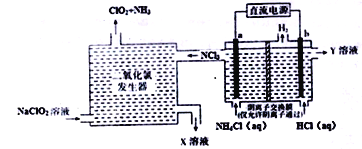
下列说法不正确的是
A. b电极接电源的负极,在b极区流出的Y溶液是稀盐酸
B. 二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
C. 电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则b极产生0.6gH2
D. 电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
难度: 中等查看答案及解析
-
H2X 和H2Y均为二元弱酸,常温下,将NaOH 溶液分别加到H2X 和H2Y的溶液中,在不同pH 环境下不同形态的粒子(即酸、酸式酸根、酸根离子)的组成分数如图所示:
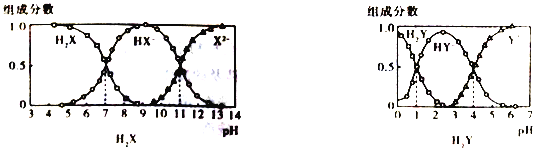
下列说法正确的是
A. 在pH=7的溶液中HX-、X2-、HY-和Y2-能大量共存
B. 向Na2X溶液中加入少量H2Y 溶液,发生反应:X2-+H2Y==HX-+HY-
C. 1L.0.1mol·L-1NaHY溶液中n(HY-)+2n(Y2-)+n(H2Y) =0.1mol
D. HX-的水解平衡常数为Kb=10-7
难度: 中等查看答案及解析
-
有四种短周期主族元素z、e、g、h,其最高价氧化物对应水化物溶液(浓度均为0.01molL﹣1)的pH与原子序数的关系如图所示。下列说法正确的是
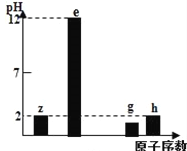
A. 离子半径大小 e>g>h
B. g位于第三周期VA族
C. e2g2中即含有离子键有含有非极性共价键
D. 同浓度简单氢化物水溶液的pH值 h >g> z
难度: 中等查看答案及解析
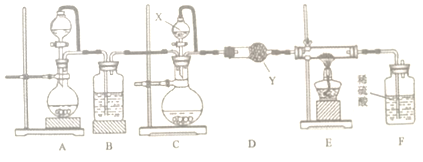
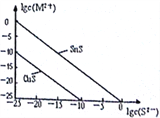
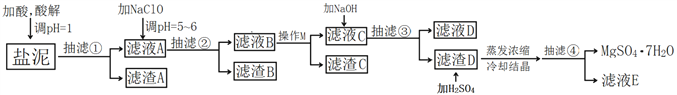
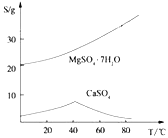
 CH3CH2OH
CH3CH2OH