-
下列反应的热效应与其它三项不相同的是
A.铝粉与氧化铁的反应 B.氯化铵与Ba(OH)2·8H2O反应
C.锌片与稀硫酸反应 D.钠与冷水反应
难度: 简单查看答案及解析
-
有专家指出,如果对燃烧产物如CO2、H2O、N2等利用太阳能使它们重新组合,使之能够实现如图转化,那么,不仅可以消除对大气的污染,还可以节约燃料,缓解能源危机.在此构想的物质循环中太阳能最终转化为
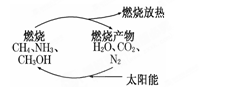
A.化学能 B.热能
C.生物能 D.电能
难度: 简单查看答案及解析
-
2008年10月8日,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋科学天才奖”。下列叙述正确的是
A.金属腐蚀就是金属失去电子被还原的过程
B.将水库中的水闸(钢板)与外加直流电源的负极相连,正极连到一块废铁上可防止水闸被腐蚀
C.合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其成分金属强
D.铜板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e- = Fe3+,继而形成铁锈
难度: 中等查看答案及解析
-
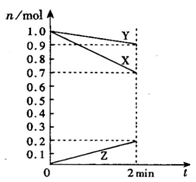
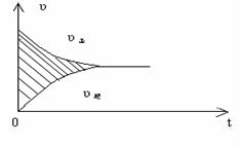
将等质量的两份锌a、b分别加入过量的稀硫酸,同时向a中加少量的CuSO4溶液,下图中产生氢气的体积V(L)与时间t(min)的关系,其中正确的是( )
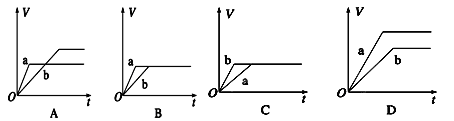
难度: 中等查看答案及解析
-
如图所示,△H1=-393.5kJ/mol, △H2=-395.4kJ/mol,下列说法或表示式正确的是
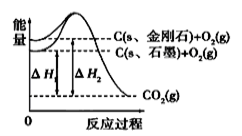
A.石墨和金刚石的转化是物理变化
B.C(s、石墨)=C(s、金刚石) △H=+1.9 kJ/mol
C.金刚石的稳定性强于石墨
D.断裂1mol石墨化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
难度: 中等查看答案及解析
-
常温下,分别将四块形状相同,质量为7 g的铁块同时投入下列四种溶液中,生成氢气速率最快的是
A.200 mL 2 mol·L-1HCl B.100 mL 2 mol·L-1H2SO4
C.100 mL 3 mol·L-1HNO3 D.50 mL 18.4 mol·L-1H2SO4
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.热化学方程式中,如没有注明温度和压强,表示反应热是在标准状况下测得的数据
B.升高温度和增加反应物的浓度,都使反应物活化分子数和活化分子百分数同时增加
C.化学反应速率可通过实验测定,比如可以测量在一定温度和压强下释放出来的气体的体积,或者可以用比色的方法测定溶液颜色的深浅进行换算
D.物质发生化学变化不一定伴随着能量变化
难度: 中等查看答案及解析
-
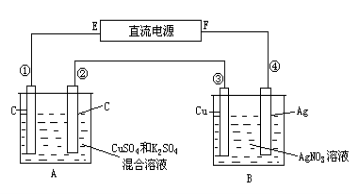
关于下列各装置图的叙述中,不正确的是
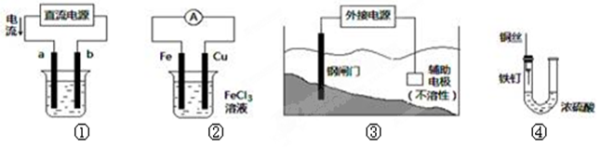
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
难度: 中等查看答案及解析
-
在同温同压下,下列各组热化学方程式中,△H2>△H1的是( )
A.S(s) + O2 (g) =SO2 (g); △H1 S(g) + O2 (g) =SO2 (g);△H2
B.2H2(g) + O2 (g)= 2H2O(g);△H1 2H2 (g) + O2 (g) = 2H2O(l);△H2
C.CO(g) + 1/2 O2(g) = CO2(g);△H1 2CO(g) + O2(g) = 2CO2 (g);△H2
D.H2 (g) +Cl2(g)=2HCl(g);△H1 1/2 H2(g) + 1/2 Cl2(g) = HCl(g);△H2
难度: 中等查看答案及解析
-
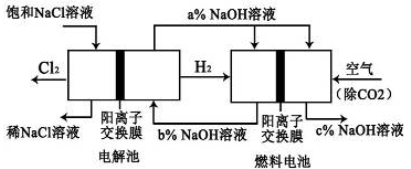
下图是水煤气(成分为CO、H2)空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中正确的是 ( )
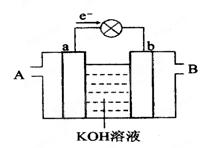
A.A处通入空气,B处通入水煤气
B.a电极的反应式包括:CO+4OH--2e-= CO32-+2H2O
C.a电极发生还原反应,b电极发生氧化反应
D.如用这种电池电镀铜,当镀件增重6.4g,则消耗标准状况下的水煤气4.48 L
难度: 中等查看答案及解析
-
用铂电极电解一定质量某浓度的CuSO4,一段时间后停止电解。若此时加入19.6gCu(OH)2,所得溶液恰好与原溶液完全相同,则下列说法不正确的是( )
A.原溶液中溶质的质量为32g
B.电解过程中转移电子的物质的量为0.8mol
C.电解过程中阳极产生的气体在标准状况下的体积为4.48L
D.最终,阴极得到气体的体积大于阳极得到气体的体积
难度: 中等查看答案及解析
-
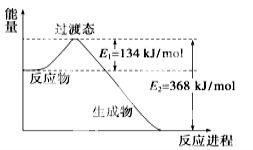
甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g);ΔH=+49.0 kJ·mol-1
②CH3OH(g)+
O2(g)===CO2(g)+2H2(g);ΔH=-192.9 kJ·mol-1
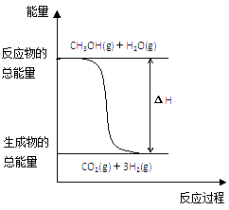
下列说法正确的是
A.若用甲醇(CH3OH)为原料设计成燃料电池,则通入甲醇的电极为正极
B.反应①中的能量变化如上图所示
C.CH3OH转变成H2的过程一定要吸收能量
D.根据②推知反应:CH3OH(l)+
O2(g)===CO2(g)+2H2(g) 的ΔH>-192.9 kJ·mol-1
难度: 中等查看答案及解析
-
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:
Pb+PbO2+4H++2SO42-
2PbSO4+2H2O,
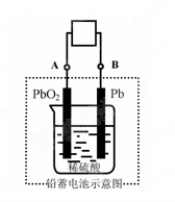
则下列说法正确的是:
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb-2e-+SO42-
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4-2e-+2H2O
PbO2+SO42-+4H+
难度: 中等查看答案及解析
-
目前人们正研究开发一种高能电池——钠硫电池,它以熔融的钠、硫为两极,以Na+导电的
陶瓷作固体电解质,反应为
,以下说法正确的是
A.放电时,硫作负极,电极反应式为:
+2e-=Sx2-
B.放电时,电池中消耗4.6g Na,反应中转移1.204×1023个电子
C.该反应一定是一个自发进行的吸热反应。
D.放电时,电子从钠极经外电路流向到硫极,再从硫极经内电路流向钠
难度: 中等查看答案及解析
-
炽热的炉膛内有反应:C(s)+O2(g)=CO2(g),△H=-392kJ·mol—1 往炉膛内通入水蒸汽时,有如下反应:C(s)+H2O(g)=CO(g)+H2(g),△H=+131 kJ·mol—1 CO(g) + 1/2O2(g)= CO2(g),ΔH=-282 kJ·mol—1 H2(g)+1/2O2(g)=H2O(g),△H=-241kJ·mol—1,由以上反应推断往炽热的炉膛内通入水蒸汽时( )
A、既能使炉火更旺,又能节省燃料
B、虽不能使炉火更旺,但可以节省燃料
C、不能节省燃料,但能使炉火瞬间更旺
D 、既不能使炉火更旺,又不能节省燃料
难度: 中等查看答案及解析
-
用Pt电极电解含有各0.1 mol Cu2+和X3+的溶液,阴极析出固体物质的质量m(g)与溶液中通过电子的物质的量n(mol)的关系见图所示。则离子的氧化能力由大到小排列正确的是
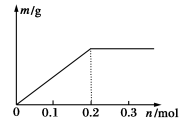
A.Cu2+>X3+>H+ B.H+>X3+>Cu2+
C.X3+>H+>Cu2+ D.Cu2+>H+>X3+
难度: 困难查看答案及解析
-
利用生活中常见的材料可以进行很多科学实验,甚至
制作出一些有实际应用价值的装置来,下图就是一个用废旧材料制
作的可用于驱动玩具的电池的示意图。上述电池工作时,有关说法
正确的是
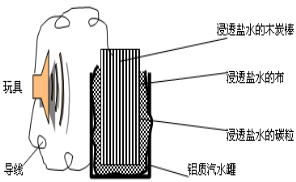
A.铝罐将逐渐被腐蚀
B.碳粒和炭棒上发生的反应为:O2+4e-=2O2-
C.炭棒应与玩具电机的负极相连
D.该电池工作一段时间后炭棒和炭粒的质量会减轻
难度: 中等查看答案及解析
-
已知:①H2O(g)=H2O(l) △H1=-Q1 kJ·mol—1;
②C2H5OH(g)=C2H5OH(l) △H2=-Q2 kJ·mol—1
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3=-Q3 kJ·mol—1
若使23g酒精液体完全燃烧,生成稳定的氧化物,最后恢复到室温,则放出的热量是多少kJ( )
A.Q1+ Q2+Q3 B.0.5(Q1+Q2+Q3)
C.0.5 Q1-1.5 Q2+0.5Q3 D.1.5Q1-0.5Q2+0.5Q3
难度: 中等查看答案及解析
-
某化学课外学习小组设计了电解饱和食盐水的简易装置见下图,下列有关说法正确的是( )
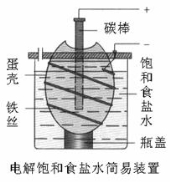
A.电解一段时间后,往蛋壳中溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
难度: 中等查看答案及解析
-
将质量相等的铜片和铂片插入硫酸铜溶液中,铜片与电源正极相连铂片与电源负极相连,以电流强度1A通电10min,然后反接电源,以电流强度2A继续通电10min。下列表示铜电极.铂电极.电解池中产生气体的质量和电解时间的关系图正确的是( )
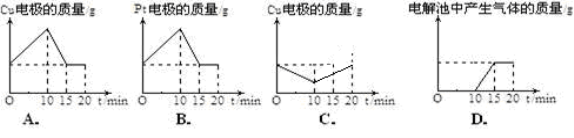
难度: 困难查看答案及解析
-
将含有0.4 mol CuSO4和0.2 mol KCl的水溶液1 L,用惰性电极电解一段时间后,在一个电极上析出19.2 g Cu,此时在另一电极上放出的气体在标准状况下的体积为(忽略气体在水中的溶解)
A.3.36 L B.4.48 L C.5.60 L D.6.72 L
难度: 中等查看答案及解析