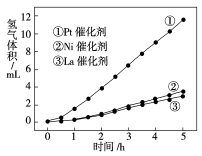
-
已知:H2(g)+Cl2(g)===2HCl(g) ΔH=-Q kJ·mol-1(Q>0),下列说法正确的是( )
A.在一定条件下,1个氢气与1个氯气反应生成2个氯化氢放出Q kJ热量
B.在一定条件下,1 mol氢气与1 mol氯气反应生成2 mol液态氯化氢放出Q kJ热量
C.在相同条件下,1 mol氢气与1 mol氯气的能量总和大于2 mol氯化氢气体的能量
D.在标准状况下,1L氢气和1 L氯气完全反应生成2L氯化氢气体放出QkJ热量
难度: 简单查看答案及解析
-
下列有关说法正确的是( )
A.燃料电池工作时,燃料在负极被还原
B.氯碱工业采用的是以铜为电极,阳离子交换膜来电解饱和食盐水
C.
有Mg、Al和NaOH溶液组成的原电池,其负极为铝,电极反应为Al-3e- = Al3+
D.二次电池充电时,电池负极连接到外接电源的负极
难度: 简单查看答案及解析
-
在一体积固定的密闭容器中通入2mol A和1mol B,一定条件下发生如下反应:
2A(g)+B(g)
3C(g) ΔH<0,反应达到平衡后,改变一个条件(x),下列量(y)一定符合图中曲线的是( )
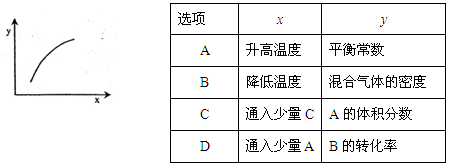
难度: 简单查看答案及解析
-
对于已达到平衡状态的可逆反应:A+B
C+D,若t1时增大压强,正、逆反应速率变化如图所示,下列有关A、B、C、D四种物质的状态叙述中正确的是( )
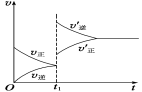
A.A、B、C、D一定都是气体
B.A、B一定都是气体,C、D只有一种是气体
C.C、D一定都是气体,A、B只有一种是气体
D.C、D至少有一种是气体,A、B也至少有一种是气体
难度: 简单查看答案及解析
-
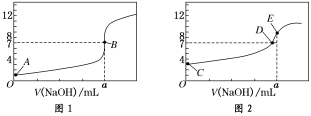
室温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=2的溶液中:Na+、Al3+、NO3-、Cl-
B.惰性电极电解的Cu SO4溶液:Na+、Fe2+、NO3-、Cl-
C.1.0 mol/L的NaAlO2溶液中:K+、Ca2+、NO3-、HCO3-
D.由水电离的c(H +) = 1.0×10-13mol/L的溶液中:K+、NH4+、SO42-、NO3-
难度: 简单查看答案及解析
-
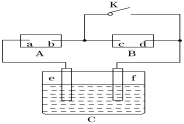
按图甲装置进行实验,若图乙中横坐标x表示通过电极的电子的物质的量,下列叙述正确的是 ( )
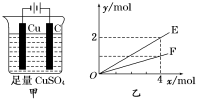
A.电解过程中,Cu2+浓度不变
B.E表示反应生成O2的物质的量
C.电解过程中,石墨棒附近溶液的pH有所增大
D.若向烧杯中加入2 mol CuO可以使电解质恢复到电解前的浓度,则电解过程中共转移了4mol电子。
难度: 困难查看答案及解析
-
将0.1 mol AgNO3和0.2mol Cu(NO3)2固体溶于水配成100 mL溶液,用惰性电极电解一段时间后,在一极上析出0.15 mol O2,此时,另一极上析出的气体体积(标准状况)为( )
A.1.12L B.2.24 L C.3.36 L D.4.48L
难度: 中等查看答案及解析
-
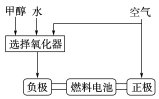
某同学设计了如图所示的盐桥式原电池,下列说法正确的是( )
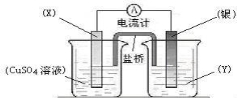
A.X若为Fe、Y可以为Na2SO4溶液
B.X若为Cu、Y可以为AgNO3溶液
C.电子由X电极经盐桥流向Ag电极
D.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
难度: 中等查看答案及解析
-
已知H2(g)+I2(g)
2HI(g) ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1 mol,乙中加入HI 0.2 mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是( )
A.甲中充入HI气体,乙中不变 B.甲降低温度,乙增大压强
C.甲中加入0.1 mol He,乙中不变 D.甲增加0.1 mol H2,乙增加0.1 mol I2
难度: 简单查看答案及解析
-
在0.1mol/L的NaHCO3溶液中,下列关系式正确的是( )
A.c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)
B. c(Na+)+ c(H+)=c(HCO3-)+c(OH-)
C.c(H2CO3)+c(H+)=c(OH-)+c(CO32-)
D. c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3)
难度: 简单查看答案及解析
-
在恒容密闭容器中,NH3和NO在一定条件下发生如下反应:
2NH3(g) + NO(g)
2N2(g) + 3H2O(g) ΔH<0 下列有关说法正确的是( )
A.其它条件不变时,使用高效催化剂,不可以使NO的转化率增大
B.平衡时,其它条件不变,充入NH3,平衡向右移动,NH3的转化率增大
C.当混合气体的密度不变了,则反应达到化学平衡状态
D.平衡时,其它条件不变,升高温度可使该反应的平衡常数增大
难度: 中等查看答案及解析
-
下列有关化学实验事实描述正确的是( )
A.Na2CO3溶液呈碱性的原因是:CO32-+2H2O
H2CO3+2OH-
B.用NaAlO2溶液可以鉴别Na2CO3溶液和NaHCO3溶液
C.有NH4+浓度相等的NH4Cl、CH3COONH4和NH4Al(SO4)2三种溶液,测得相同温度下溶质浓度最大的是NH4Al(SO4)2溶液
D.AlCl3溶液和NaAlO2溶液加热蒸干所得主要成分都是Al(OH)3固体
难度: 困难查看答案及解析
-
下列相关实验能达到预期目的的是( )
相关实验
预期目的
A
相同温度下,将等质量的大理石块、大理石粉末分别加入等体积、等浓度的盐酸和醋酸中,观察气泡产生的快慢
验证固体接触面积对化学反应速率的影响
B
可逆反应FeCl3(aq)+3KSCN(aq)
Fe(SCN)3(aq)+3KCl(aq)建立平衡后,在其它条件不变时,加入KCl固体,观察体系颜色的变化
验证浓度对化学平衡的影响
C
室温下,向BaSO4悬浊液中加入饱和Na2CO3溶液,过滤后,再向沉淀中加入盐酸,沉淀部分溶解
验证BaSO4和BaCO3Ksp的相对大小
D
相同温度下,两支试管中装有等体积、等浓度的H2O2溶液,向其中分别加入少量FeCl3固体和少量的MnO2固体
验证不同催化剂对H2O2分解速率的影响
难度: 困难查看答案及解析
-
下列有关电解质溶液的推理,其中不正确的是( )
A.室温下,pH=4的CH3COOH溶液和pH=10的NaOH溶液等体积混合, 所得溶液pH<7
B.用蒸馏水稀释0.1mol/L CH3COOH溶液至0.01mol/L,若稀释过程温度不变,则稀释过程中c(H+) / c(CH3COOH)呈增大的趋势
C.将0.2mol/L的弱酸HX溶液与0.1mol/L的NaOH溶液等体积混合,充分反应后,溶液中存在:2c(OH-) +c(X-)=2c(H+) + c(HX)
D.用0.2mol/L的NaOH标准溶液滴定HCl与CH3COOH的混合溶液,当中和至中性时,溶液中存在:c(Na+)+c(CH3COOH) = c(Cl-) + c(CH3COO-)
难度: 困难查看答案及解析
-
关于室温下pH=3的醋酸和pH=3盐酸溶液,下列有关叙述正确的是( )
A.二者水溶液中,水的电离程度相等
B.均加水稀释10倍后,溶液的pH:醋酸>盐酸
C.加水稀释,CH3COOH的电离程度在增大,溶液的导电能力在增强
D.加入足量的Mg粉充分反应后,产生H2的体积V(相同状况):醋酸>盐酸
难度: 中等查看答案及解析
-
可逆反应mA(s)+nB(g)
pC(g)+qD(g) ΔH=Q kJ·mol-1在反应过程中,当其它条件不变时,C的体积分数Φ(C)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。
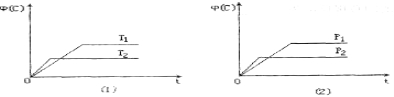
下列叙述正确的是( )
A.T1 > T2 P1 > P2 B. Q > 0 C. m+n < p+q D.该反应一定具有自发性
难度: 简单查看答案及解析