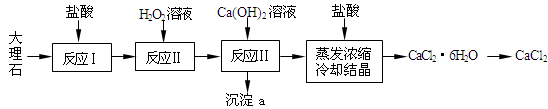
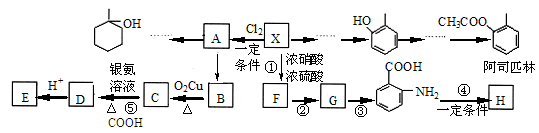
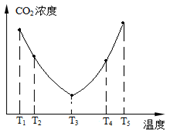
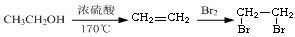-
化学与材料、生活和环境密切相关。下列有关说法中不正确的是
A.“地沟油”禁止食用,但可以用来制肥皂
B.将废弃的电池、金属、纸制品等垃圾分类回收
C.新型材料聚酯纤维、光导纤维都属于有机高分子
D.医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是
A.钾原子结构示意图:
B.间羟基苯甲酸的结构简式:
C.CO2的比例模型:

D.Na2S的电子式:
难度: 中等查看答案及解析
-
常温下,下列溶液中各组离子一定大量共存的是
A.使甲基橙呈红色的溶液中:Na+、AlO2—、NO3—、CO32—
B.c(ClO-)=1.0 mol·L-1溶液:Na+、SO32-、S2-、Cl-
C.含有0.1 mol·L-1 HCO3-的溶液:Na+、Fe3+、NO3-、C6H5O-
D.
=0.1 mol·L-1的溶液:Na+、K+、CO32-、NO3—
难度: 中等查看答案及解析
-
下列有关物质的性质与应用不对应的是
A.氨气具有还原性,可用作制冷剂
B.MgO、Al2O3熔点高,可用于制作耐火材料
C.Na2CO3溶液显碱性,可用其热溶液除去金属餐具表面油污
D.常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸
难度: 中等查看答案及解析
-
下列有关实验装置进行的相应实验,能达到实验目的的是
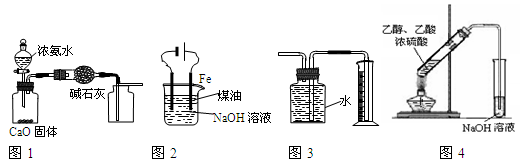
A.用图1装置制取并收集干燥纯净的NH3
B.用图2装置实验室制备Fe(OH)2
C.装置3收集并测量Cu与浓硝酸反应产生的气体及体积
D.装置4可用于实验室制取乙酸乙酯
难度: 中等查看答案及解析
-
下列各组物质中,物质之间通过一步反应就能实现图示变化的是
物质编号
物质转化关系
a
b
c
d
①
NO
NO2
N2
HNO3
②
Na2O
Na2O2
Na
NaOH
③
FeCl2
FeC13
Fe
CuCl2
④
Al2O3
NaAlO2
Al
Al(OH)3
A.①②③ B.①③④ C.③④ D.②④
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列说法正确的是
A.23gNO2和N2O4的混合气体中含有的氮原子数为0.5NA
B.4.2 g丙烯中所含的共用电子对总数为0.6NA
C.过氧化氢分解制得标准状况下1.12 L O2,转移电子数目为 0.2 NA
D.在高温、高压、催化剂的条件下,28gN2和6gH2充分反应,生成NH3的分子数为2NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.HCO3-水解的离子方程式:HCO3-+H2O
CO32-+H3O+
B.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
C.过量的SO2通入NaOH溶液中:SO2—+2OH—=SO32—+H2O
D.新制氢氧化铜和乙醛反应:CH3CHO+2Cu(OH)2+OH-
CH3COO-+Cu2O↓+3H2O
难度: 中等查看答案及解析
-
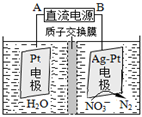
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图,有关说法正确的是
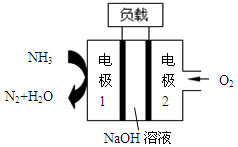
A.电池工作时,Na+ 向负极移动
B.电子由电极2经外电路流向电极1
C.电池总反应为:4NH3+3O2=2N2+6H2O
D.电极2发生的电极反应为:O2+ 4H + + 4e-=2H2O
难度: 中等查看答案及解析
-
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强。下列说法正确的是
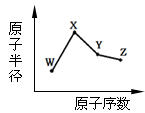
A.对应简单离子半径:X>W
B.对应气态氢化物的稳定性Y>Z
C.化合物XZW既含离子键,又含共价键
D.Y的氧化物能与Z的氢化物和X的最高价氧化物对应的水化物的溶液反应
难度: 中等查看答案及解析
-
下列有关说法正确的是
A.向醋酸钠溶液中加水稀释时,溶液中所有离子浓度都减小
B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属
C.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H<0,则该反应一定能自发进行
D.对N2(g)+3H2(g)
2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小
难度: 中等查看答案及解析
-
普罗帕酮为广谱高效抗心律失常药,它可由有机物X经多步反应合成:
普罗帕酮

下列有关说法正确的是
A.在有机物X的1H核磁共振谱图中,有4组特征峰
B.可用溴水或FeCl3溶液鉴别X和Y
C.普罗帕酮分子中有2个手性碳原子
D.X、Y和普罗帕酮都能发生加成、水解、氧化、消去反应
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是
选项 实验操作 实验现象 结论
A 向某溶液中加入盐酸酸化的BaCl2溶液 生成白色沉淀 该溶液中一定含有SO42—
B 将少量的溴水滴入FeCl2、NaI的混合溶液中,再滴加CCl4,振荡、静置,向上层溶液中滴加KSCN溶液。再向上层溶液中滴加溴水 实验现象1:
上层溶液不变红,
下层溶液紫红色
实验现象2:
上层溶液变红 氧化性:Br2>Fe3+>I2
C 取久置的Na2O2粉末,向其中滴加过量的盐酸 产生无色气体 Na2O2没有变质
D BaSO4固体加入饱和Na2CO3溶液中,过滤,向滤渣中加入盐酸 有气体生成 Ksp(BaCO3)<Ksp(BaSO4)
难度: 中等查看答案及解析
-
常温下,有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的
量浓度均为0.1mol·L−1,下列说法正确的是
A.四种溶液的pH的大小顺序:①>④>③>②
B.将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3·H2O)
C.向溶液①、②中分别滴加25mL 0.1mol·L−1盐酸后,溶液中c(NH4+):①<②
D.将溶液③、④等体积混合所得溶液中:2c(OH−)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32−)
难度: 困难查看答案及解析
-
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应2SO2(g)+O2(g)
2SO3(g) ∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
反应时间/min
n(SO2)/mol
n(O2)/mol
0
2
1
5
1.2
10
0.4
15
0.8
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1 min−1
B.保持温度不变,向平衡后的容器中再充入1molSO2和0.5molO2时,v (正)> v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
难度: 中等查看答案及解析