-
CaCl2常用于冬季道路除雪,建筑工业的防冻等,实验室常用作干燥剂。工业上常用大理石(含有少量Al3+、Fe2+、Fe3+等杂质)来制备。下图为实验室模拟其工艺流程:
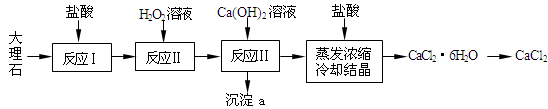
已知:常温下,溶液中的Fe3+、Al3+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,4,9.7。
(1)反应Ⅰ中,需将大理石粉碎、搅拌,同时适当加热,其目的是:________。写出反应Ⅰ中主要反应的离子方程式:________。
(2)上述使用盐酸的浓度为10%,若用37%的浓盐酸来配制500mL的此盐酸所需的玻璃仪器有:玻璃杯、量筒、烧杯、胶头滴管、________。
(3)反应Ⅱ中的离子方程式:________。
(4)反应Ⅲ中必须控制加入Ca(OH)2的量,使溶液的pH约为8.0,此时沉淀a的成分为:________,若pH过大,则可能发生副反应的离子方程式:________。
-
无水CaCl2具有强烈的吸湿性,在空气中易潮解,可用作干燥剂、脱水剂、混凝防冻剂等。以工业碳酸钙矿石(含有少量SiO2 、Fe2O3、Al2O3、FeCO3等杂质)生产无水氯化钙的主要流程如下:
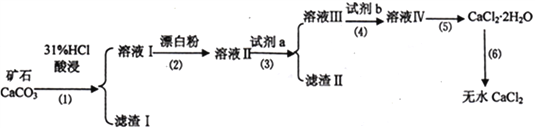
(1)为了提高步骤(1)的反应速率,可以采取的措施是________________________。
(2)加入试剂b 的目的是使溶液酸化,试剂b 可以选择下列试剂__________(填序号)。
①硫酸 ②硝酸 ③氢硫酸 ④盐酸
(3)写出步骤(2)的离子方程式______________________________。
(4)步骤(5)用到的操作方法有蒸发浓缩、______________________________。
(5)已知A13+、Fe2+、Fe3+生成氢氧化物沉淀的pH 如下:
| Al (OH)3 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀 | 3.7 | 开始溶解 | 7.8 | 6.5 | 1.5 |
| 沉淀完全 | 5.3 | 完全溶解 | 10.0 | 9.7 | 3.3 |
加入试剂a的目的是调节溶液的pH,调节pH 的范围为_______________________________。
(6)已知某一温度时Ksp[Fe(OH)3]=8.0×10-38,向0.01 mol·L-1的FeCl3 溶液中加入NaOH 固体,假设溶液的体积不变,要生成Fe(OH)3沉淀,应使溶液中的c(OH-)最小为__________mol·L-1;Fe3+沉淀完全时,溶液中c(OH-) 最小为__________mol·L-1。
(7)测定样品中Cl-含量的方法是:a.称取0.7500g 样品,溶解,在250mL 容量瓶中定容;b.量取25.00mL 待测液于锥形瓶中; c.用0.05000mol·L-1AgNO3 溶液滴定至终点,消耗AgNO3溶液体积的平均值为25.00mL。计算上述样品中CaCl2 的质量分数为________________________。
-
(12分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%-103.0%)的主要流程如下:
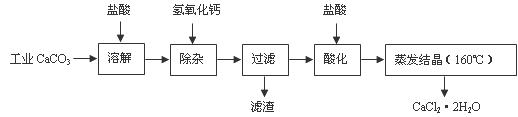
(1)除杂操作是加入氢氧化钙,调节溶液的pH为8.0-8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的试验操作是 _________________________________________________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①________________;②_______________________
(3)测定样品中Cl- 含量的方法是:a.称取0.7500 g样品,溶解在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol/LAgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①计算上述样品中CaCl2·2H2O的质量分数为__________________。
②若用上述办法测定的样品中CaCl2·2H2O的质量分数有时超过100.0%(测定过程中产生的误差可忽略),其可能原因有_____________________________。
-
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作时加入氢氧化钙固体,调节溶液的pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+,检验Fe(OH)3是否沉淀完全的实验操作是_____________________________;
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:
①___________________________;②___________________________;
(3)测定样品中Cl-含量的方法是:
A.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;B.量取25.00 mL待测溶液于锥形瓶中;C.用0.0500 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.00 mL。
①上述测定过程中不需要用盛装溶液润洗的仪器有 ,若润洗后会导致结果
②计算上述样品中CaCl2·2H2O的质量分数为________________;
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有: ; 。
(4)工业上冶炼金属钙的方法是 ;请写出此冶炼的化学反应方程式________________;
-
医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入Ca(OH)2,调节溶液pH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是________。
(2)酸化操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止Ca2+在蒸发时水解;②。
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有________。 ②计算上述样品中CaCl2·2H2O的质量分数为________。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有________;________。
-
(13分)医用氯化钙可用于生产补钙、抗过敏和消炎等药物。以工业碳酸钙(含有少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2·2H2O的质量分数为97.0%~103.0%)的主要流程如下:

(1)除杂操作是加入氢氧化钙,调节溶液的PH为8.0~8.5,以除去溶液中的少量Al3+、Fe3+。检验Fe(OH)3是否沉淀完全的实验操作是__________。
(2) 酸化操作是加入盐酸,调节溶液的PH约为4.0,其目的有:①将溶液中的少量Ca(OH)2转化为CaCl2;②防止Ca2+在蒸发时水解;③__________。
(3)测定样品中Cl-含量的方法是:a.称取0.7500 g样品,溶解,在250mL 容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用0.05000 mol·L-1 AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有__________。
②计算上述样品中CaCl2·2H2O的质量分数为__________。
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有__________;__________。
-
溴化钙(CaBr2·2H2O)是一种白色晶体,易溶于水,有很强的吸湿性,是光敏纸矿泉水和灭火剂的重要成分,在医药上用作治疗神经衰弱等的药物,也用作化学分析。用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下
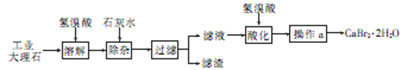
回答下列问题
(1)溶解时发生的主要反应的离子方程式为________
(2)除杂步骤控制溶液的pH约为8.0的目的是________,________
(3)滤液用氢溴酸酸化的目的是________,操作a主要包括,________和过滤
(4)制得的溴化钙晶体可以通过如下步骤测定其纯度:
①称取5.00g溴化钙晶体样品,②溶解;③滴入足量Naa2CO3溶液,充分反应后过滤,④烘干、冷却;⑤称量。若得到2. 00 g碳酸钙,则样品的纯度为________
(5)溴化钙晶体中溴离子和钙离子的检验
①将少量溴化钙晶体溶于水,加入硝酸酸化的AgNO3溶液,实验现象为________,发生反应的离子方程式为________
②将少量溴化钙晶体溶于水,滴加草酸钠溶液,实验现象为________,发生反应的离子方程式为________
-
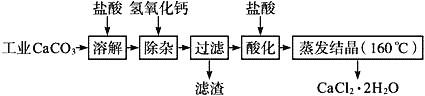
医用氯化钙可用于生产补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2、2H2O的质量分数为97.0%~103.0%)的主要流程如下:
已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Al(OH)3 |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解时的pH | 7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解时的pH | 10.8 |
(1)CaCO3与盐酸反应的离子方程式___________。
(2)“除杂”操作是加入氢氧化钙,调节溶液的pH范围为________,目的是除去溶液中的少量Al3+、Fe2+。
(3)过滤时需用的比玻璃器有__________。
(4)“酸化”操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止氢氧化钙吸收空气中的二氧化碳;②防止Ca2+在蒸发时水解;③_______。
(5)蒸发结晶要保持在160℃的原因是__________。
(6)测定样品中Cl-含量的方法是:称取0.750 0 gCaCl2·2H2O样品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中;用0.050 00 mol/L AgNO3溶液滴定至终点(用K2Cr2O2),消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有________。
②计算上述样品中CaCl2·2H2O的质量分数为_______。(保留四位有效数字)
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有________;__________。
-
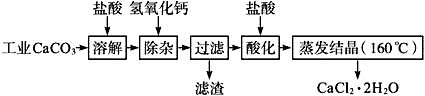
医用氯化钙可用于生产补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2、2H2O的质量分数为97.0%~103.0%)的主要流程如下:
已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Al(OH)3 |
| 开始沉淀时的pH | 2.3 | 4.0 | 开始溶解时的pH | 7.8 |
| 完全沉淀时的pH | 3.7 | 5.2 | 完全溶解时的pH | 10.8 |
| | | | |
(1)CaCO3与盐酸反应的离子方程式___________。
(2)“除杂”操作是加入氢氧化钙,调节溶液的pH范围为________,目的是除去溶液中的少量Al3+、Fe2+。
(3)过滤时需用的比玻璃器有__________。
(4)“酸化”操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止氢氧化钙吸收空气中的二氧化碳;②防止Ca2+在蒸发时水解;③_______。
(5)蒸发结晶要保持在160℃的原因是__________。
(6)测定样品中Cl-含量的方法是:称取0.750 0 gCaCl2·2H2O样品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中;用0.050 00 mol/L AgNO3溶液滴定至终点(用K2Cr2O2),消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有________。
②计算上述样品中CaCl2·2H2O的质量分数为_______。(保留四位有效数字)
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有________;__________。
-
(16分)医用氯化钙可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为:
(可能用到的原子量:Cl 35.5 Ca 40 O 16 )

(1)CaCO3与盐酸反应的离子方程式________。
(2)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有________。滤渣主要成分的化学式________。
(3)酸化时加盐酸的目的为:
①________,
②防止Ca2+ 在蒸发时发生水解。
(4)为什么蒸发结晶要保持在160℃:________。
(5)为测定样品中CaCl2 ·2H2O的含量,称取0.7522g样品并配成250mL溶液,分别取该溶液25.00mL于三个锥形瓶中,用0.04mol/LAgNO3溶液进行三次滴定,消耗 AgNO3溶液的平均体积为20.39mL。
①通过计算,样品中含CaCl2 ·2H2O的质量分数________。(只写计算式不计算结果)。
②若所测样品 CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为________。









