-
溴化钙(CaBr2·2H2O)是一种白色晶体,易溶于水,有很强的吸湿性,是光敏纸矿泉水和灭火剂的重要成分,在医药上用作治疗神经衰弱等的药物,也用作化学分析。用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下
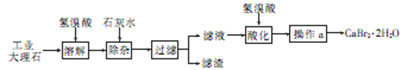
回答下列问题
(1)溶解时发生的主要反应的离子方程式为________
(2)除杂步骤控制溶液的pH约为8.0的目的是________,________
(3)滤液用氢溴酸酸化的目的是________,操作a主要包括,________和过滤
(4)制得的溴化钙晶体可以通过如下步骤测定其纯度:
①称取5.00g溴化钙晶体样品,②溶解;③滴入足量Naa2CO3溶液,充分反应后过滤,④烘干、冷却;⑤称量。若得到2. 00 g碳酸钙,则样品的纯度为________
(5)溴化钙晶体中溴离子和钙离子的检验
①将少量溴化钙晶体溶于水,加入硝酸酸化的AgNO3溶液,实验现象为________,发生反应的离子方程式为________
②将少量溴化钙晶体溶于水,滴加草酸钠溶液,实验现象为________,发生反应的离子方程式为________
-
溴化钙医药上用作中枢神经抑制药,具有抑制、镇静作用,用以治疗神经衰弱、癫痫等症,在水中极易溶解,溶于乙醇和丙酮。制备溴化钙晶体(CaBr2·2H2O)的主要流程如下:
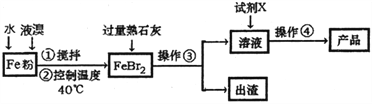
(1)检验FeBr2中是否含有Fe3+,应选择________(填字母编号)。
a.NaOH溶液 b.K3[Fe(CN)6]溶液 c.KSCN溶液 d.KMnO4溶液
(2)操作②要求控制温度在40℃,不能过高和过低的原因是_____________________。
(3)要实现Fe粉至FeBr2的转化,在原料配比时应注意_____________,试剂X的化学式为_______________。
(4)加入熟石灰至出渣的过程中,固体的颜色发生变化,原因是___________(用化学反应方程式表示。)
(5)操作④的步骤为蒸发浓缩、__________、过滤、洗涤、干燥。蒸发浓缩时除酒精灯、三脚架外还需用到仪器有____________。
(6)将氨气通入石灰乳,加入溴,于65℃进行反应也可制得溴化钙,此反应中还会生成一种无色无味气体,写出反应的化学方程式_____________。
(7)将上述流程中的出渣,经净化分离得到铁粉。已知25℃,101kPa时:
4Fe(s)+3O2(g)=2Fe2O3(s) △H=-1648kJ/mol
C(s)+O2(g)=CO2(g) △H=-393kJ/mol
4FeCO3(s)+O2(g)=2Fe2O3(s)+4CO2(g) △H=-260kJ/mol
将铁粉与碳、氧气共同作用可以得到FeCO3,则该反应的热化学反应方程式为__________。
-
溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
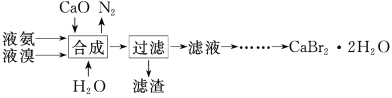
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作(装置如图):

使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,_______________。
(2)“合成”主要反应的化学方程式为__________________。“合成”温度控制在70℃以下,其原因是_________。投料时控制n(Br2)∶n(NH3)=1∶0.8,其目的是_________________。
(3)“滤渣”的主要成分为____________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,用氢溴酸调节滤液呈酸性,加入活性炭脱色,用砂芯漏斗过滤,___________________。[实验中须使用的试剂:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器:砂芯漏斗,真空干燥箱]
-
溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
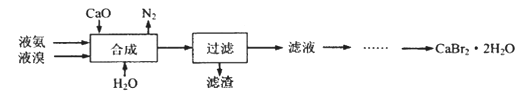
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。
(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
-
溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:

(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。

(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
-
溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:

(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。

(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
-
(14分)溴化钙是一种溴化物,用于石油钻井,也用于制造溴化铵及光敏纸、灭火剂、制冷剂等。制备CaBr2·2H2O的主要流程如下:

(1)与液溴的反应温度不能超过40℃的原因是 。
(2)滤渣的成分可能是 。
(3)试剂M是 ,加入M的目的是 。
(4)操作Ⅱ的步骤为蒸发浓缩、 、洗涤、干燥
(5)将氨气通入石灰乳,加入溴,于65°C进行反应也可制得溴化钙,此反应中还会生成一种无色气体,写出反应的化学方程式 。
(6)制得的CaBr2·2H2O可以通过以下方法测定纯度:称取5.00g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将滤渣洗涤、烘干、冷却,称量。得到2.00g固体,则CaBr2·2H2O的质量分数为 。(相对原子质量:Ca—40 Br—80 H—1 O—16)
-
氯化钡是白色的晶体,易溶于水,微溶于盐酸和硝酸,难溶于乙醇和乙醚,易吸湿,需密封保存。工业上制备BaCl2·2H2O有如下两种途径:
途径1:以重晶石(主要成分BaSO4)为原料,流程如下:
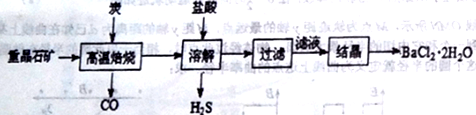
(1)写出“溶解”时反应的化学方程式方程式:________________________。
(2)“高温焙烧”时必须加入过量的炭,同时还要通入空气,其目的是_____________。
(3)结晶得到的晶体,需用乙醇洗涤的理由是_______________________。
途径2:以毒重石(主要成分BaCO3,含CaCO3、MgCO3、Fe2O3、SiO2等杂质)为原料,流程如下:
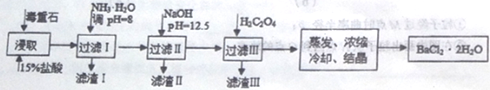
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9,Ksp[Mg(OH)2]=1.8×10-11。
| Ca2+ | Mg2+ | Fe3+ |
| 开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
| 完全沉淀时的pH | 13.9 | 11.1 | 3.7 |
(4)滤渣I的成分为________(填化学式)。
(5)滤渣II中含_________(填化学式)。过滤析出后,滤液中含有的Mg2+浓度为_______。
(6)加入H2C2O4时应避免过量,其原因是为了防止生成______(填化学式)。
-
溴化钙是一种重要的溴化物,可用于制造光敏纸、灭火剂、制冷剂等,以石灰乳、液溴及氨等为原料制备CaBr2•2H2O的实验流程如下:
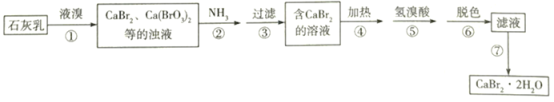
(1)步骤①需控制在70℃以下,温度不宜过高的原因是________________。
(2)下列实验室制取少量NH3的方法正确的是_____________(填标号)。
A. B.
B. C.
C.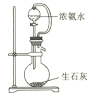 D.
D.
(3)已知NH3被氧化为N2。步骤②中发生反应的化学方程式为_______________________。
(4)步骤④、⑤的目的依次是_______________________________、________________________。
(5)步骤⑥常用_________________进行脱色,它利用了该物质的____________________。
(6)步骤⑦得到产品的操作方法是__________________________________________。
-
溴化钙可用于石油钻井,也可用于制造溴化铵及光敏纸、灭火剂、制冷剂等。制备CaBr2•2H2O的主要流程如下:

工业提取液溴主要采用空气吹出法,其主要流程如下:

请回答:
(1)Fe与液溴的反应温度不能超过40℃的原因是 。
(2)试剂B最好选用 。
(3)操作Ⅰ的步骤为蒸发浓缩、 、洗涤、干燥。
(4)下列说法中错误的是 。
a.滤渣A的成分可能是Fe、Fe(OH)2 、Fe(OH)3;
b.操作Ⅱ的名称是萃取
c.流程图中虚线框部分步骤的主要目的是除去杂质、富集Br2
d.成品溴中含有的少量Cl2,可加入Na2SO3溶液,然后分液除去
(5)制得的CaBr2•2H2O可以通过以下方法测定纯度:称取5.00 g样品溶于水,滴入足量Na2CO3溶液,充分反应后过滤,将沉淀洗涤、烘干、冷却、称量,得到2.00 g固体。
①纯度测定中用到的玻璃仪器有胶头滴管、酒精灯、 。
②洗涤沉淀的操作方法是 。
③测得CaBr2•2H2O的质量分数为 。













 B.
B. C.
C. D.
D.

