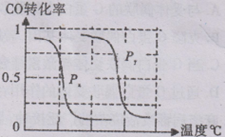
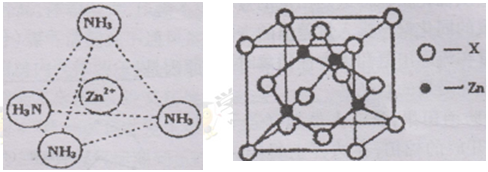
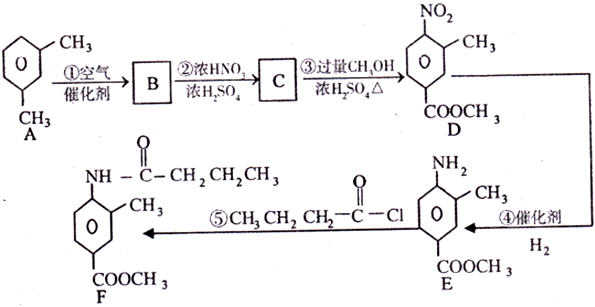
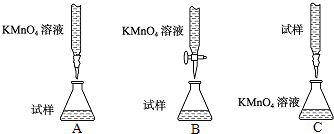
-
下列说法中错误的是
A.电解饱和食盐水,生成物总能量比反应物总能量高
B.能自发进行的化学反应,不一定是△H<0,△S>0
C.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高
D.食盐可用于融化冰雪,且用食盐作融雪剂不会对环境、植物生长产生任何危害
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是
A.在反应KIO3 + 6 HI=KI + 3I2+3 H2O中,每生成3mo1 I2转移的电子数为5NA
B.100mL 18.4mo1·L-1硫酸与足量Cu反应,生成SO2的分子数为0.92NA
C.1L 0.1 moI·L-1的CH3COOH溶液中所含的离子和分子总数为0.1NA
D.将0.lmol FeC13滴人沸水中可制得0.1NA Fe(OH)3胶粒
难度: 中等查看答案及解析
-
下列有机物有两种同分异物体的是
A.甲烷的二氯代物 B.二氯苯
C.异丁烷的一氯代物 D.异戊烷的一氯代物
难度: 中等查看答案及解析
-
盐酸、醋酸和碳酸氢钠是生活中常见的物质。下列表达不正确的是
A.在NaHCO3溶液中加入与其等物质的量的NaOH ,溶液中的阴离子只有CO32-和OH-
B.NaHCO3溶液中:c(HCO3- ) +c(H2CO3) +c(CO32-)=c(Na+)
C.相同温度下,l0mL 0.lmol·L-1的醋酸与100mL 0.01 mol·L-1的醋酸中H+的物质的量不相等
D.相同温度下,中和体积与pH都相同的HCI溶液和CH3COOH溶液所消耗的NaOH的物质的量,后者多
难度: 困难查看答案及解析
-
下列叙述中正确的组合是
①酸酐一定是氧化物且是非金属氧化物 ②碱性氧化物一定是金属氧化物 ③不能与酸反应的氧化物一定能跟碱反应 ④氧化物与水的反应都是化合反应 ⑤由分子式相同的分子组成的物质一定是纯净物 ⑥某化合物若含阴离子则一定含阳离子
A.①②⑤⑥ B.②④⑥ C.②⑥ D.①②④⑤
难度: 中等查看答案及解析
-
为确定某溶液的离子组成,进行如下实验:
①常温下,测定溶液的pH溶液呈强碱性;②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体;③在②反应后的溶液中再滴加Ba(NO3)2溶液,产生白色沉淀;④取上层清液继续滴加 Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀。根据实验,以下对原溶液中大量存在的离子的推测正确的是
A.一定含SO32- B.一定含CO32- C.C1-一定存在 D.不能确定HCO3-是否存在
难度: 中等查看答案及解析
-
下表各组物质中,不可以实现x
y
z(每步只发生一个化学反应)所示转化的选项是
选项 x y z M
A NaOH Na2CO3 NaHCO3 CO2
B NH3 N2 NO O2
C Al3+ Al(OH)3 AlO2- OH-
D Fe FeCl2 FeCl3 Cl2
难度: 中等查看答案及解析